Металлургия кобальта и никеля
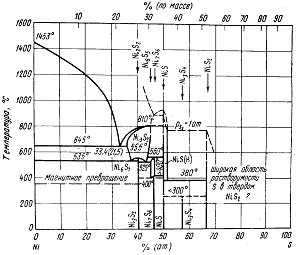
Рис. Диаграмма состояния системы Ni—S
Оксид NiO, называемый часто закисью никеля, — твердое серое вещество. С кислотами дает простые соли, а со щелочами не реагирует.
Оксид Ni (III) известен в виде гидроокиси, получаемой действием сильных окислителей в водных растворах, также синтезирована неустойчивая двуокись NiO2.
Сульфид никеля NiS выделяется действием сероводорода на водные растворы Ni2+, после сушки и нагревания он диссоциирует с отделением серы и через ряд промежуточных состояний достигает устойчивого в металлургических расплавах раствора состава Ni3S2 (рис.).
Система Со — О мало отличается от предыдущей, но менее изучена. При высоких температурах, помимо СоО, устойчив Со3О4, а из водных растворов можно выделить Со2О3•nН2О, по окислительным свойствам уступающую Ni2О3mН2О.
Кобальт с серой дает в водных растворах CoS, а при высоких температурах — ряд сульфидов (CoS2, Co3S4, CoS, Co9S8), завершаемый CO4S3 и твердым раствором в нем металла.
Никель и кобальт легко восстанавливаются из окислов углеводородом и водородом, а из водных растворов солей —электролизом. Они ферромагнитны: никель до 358, кобальт до
1130° С.
С кислородом, серой и галогенами оба металла при обычных
температурах реагируют медленно, а при нагревании — энергично. Из кислот они медленно выделяют водород, а против щелочей устойчивы. Соли сильных кислот хорошо растворимы в
воде а соли слабых — в большинстве плохо; гидроокиси имеют слабоосновной характер.
Карбонилы никеля и кобальта — комплексные соединения, подобные известным для других переходных элементов. Атомы металлов и углерода связаны электронной парой СО-группы с участием р-электронов металла. Хорошо изучены следующие карбонилы: Ni(CO)4, Со2(СО)8, Со4(СО)2.
Для металлургии наиболее важны аммиачные комплексы никеля и кобальта общего вида Ме(NH3)2n+. У никеля почти одинаково прочны соединения с координационными числами 5 и 6(pK = 8 10 и 8,01), а у кобальта (рK=5,07 и 5,13).
Статья на тему Металлургия кобальта и никеля

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.