ПЕРЕРАБОТКА КОНЦЕНТРАТОВ ПЛАТИНЫ
NO3— + 4H+ + 3e = NO + 2H2O; E0 = 0,95B
Au — 3e = Au3+; E0 = 1,50B;
Au + 4Cl— = AuCl4—; pK = 21,3
Au + NO3— + H+ + 4Cl— = AuCl4— + NO + 2H2O
pKAu3+/NO = ((1,50 — 0,95):0,06)3 = 27,5; pK = 27,5 — 21,3 = 6,2
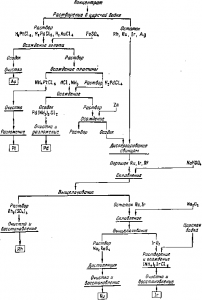
Рис. Краткая схема переработки концентратов платины и палладия, содержащих другие платиноиды
На первый взгляд, реакция кажется невозможной из-за малой величины К; однако в царской водке, состоящей из трех объемов HCl (d=l,19 г/см3) и одного объема HNO3 (d=l,4 г/см3), на 1 кг воды приходится 12,8 моля НСl и 5,2 моля HNO3. Коэффициенты активности этих кислот с концентрацией увеличиваются. Приняв максимальную из известных цифр: для 3-моляльной HNO3 γ± = 0,9, а для 6-моляльной НСl γ± = 3,22, получим aAuCl4— =3 • 0,9 (6 • 3,22)4 1,6 • 10-6=4,9.
Для АuСl4— коэффициент активности неизвестен; однако и без того видна
возможность значительного накопления этого иона в растворе, даже при обычных температурах. Полагают, что практически наблюдаемое быстрое растворение золота в царской водке связано с промежуточным образованием хлористого нитрозила NOCl.
Платина, палладий и частично иридий переходят в раствор по подобным реакциям и следующей общей схеме:
3Ме + 18Сl— + 4NO3— + 16Н+ = 3МеCl26—+ 4NO + 8Н2O
Из приведенных ниже окислительно-восстановительных систем легко вычислить константы равновесия KPd =102, КIr =1094:
Pd + 6Сl— — 4е = PdCl26—; E0 = 0,96 В,
Іr + 6Сl— — 4e = IrCl26—; E0 = 0,83 В.
Аналогичных данных для платины нет. Практика показывает, что она растворяется легче иридия, но труднее палладия. Родий и рутений при действии царской водки окисляются медленно, вероятно, по схемам:
Rh + 6Сl— — 3е = RhCl36—; E0 = 0,44 В,
Ru + 3Сl— — 3е = RuCl3; E0=0,68В, а суммарно по уравнениям:
Rh + 6 Сl— + NO3— + 4Н+ = RhCl36— + NO + 2Н2O,
Ru + 3Сl— + NO3— + 4Н+ = RuCl3 + NO + 2N2O.
Как и во многих других случаях, скорости реакций не соответствуют величинам констант равновесия, а контролируются кинетикой окисления либо комплексообразования.
После суточного нагревания и перемешивания в раствор практически полностью переходят палладий, золото и платина, а иридий — только частично. В нерастворимом остатке, масса которого около 5%, например, содержится 30% иридия, 12% рутения, 10% платины. и3% родия.
Платину из фильтрата осаждают хлористым аммонием в виде труднорастворимого гексахлороплатината (IV) аммония. Для получения чистого осадка иридий и палладий предварительно восстанавливают в соответствии со следующими системами:
IrCl26— + e = IrCl36— ; E0= 1,02 В.
PdCl26— + 2е = PdCl24— + 2Сl—; E0 = 1,29 В.
Применяют разные восстановители, а в данном случае сул фат железа (II), который одновременно осаждает золото:
AuCl4— + 3Fe2+ = Au + 3Fe3+ + 4Сl—,
PbCl26— + 2Fe2+ = PdCl24— + 2Fe3+ + 2Сl—.
Промытый и высушенный осадок гексахлороплатината (IV) аммония прокаливают при температуре 800° С, получая ковкий серый порошок металла — платиновую губку, которая обычно требует еще сложной дополнительной очистки.
Палладий переводят в тетрахлоропалладат (II) аммония добавлением аммиака, а затем, осторожно подкисляя раствор соляной кислотой, выделяют желтый кристаллический осадок транс-дихлордиаминопалладия (хлорпалладозамина):
(NH4)2PdCl4+4NH3 = Pd(NH3)4Cl2 + 2NH4Cl,
Pd (NH3)4 Cl2 + 2Н+ = [Pd (NH3)2 Cl2] + 2NH4+
Прокаливая эту соль, получают порошок палладия.
Остаток от обработки царской водкой диспергируют — плавят со свинцом, гранулируют и растворяют в азотной кислоте. В раствор отходят серебро и свинец, а мелкий порошок платиноидов для выделения родия сплавляют с бисульфатом натрия и выщелачивают водой.
Родий в виде Rh2(SO4)3 растворяется. Действием щелочи осаждают его гидроокись, которую вновь растворяют:
Rh2 (SO4)3 + 6NaOH = 2Rh (OH)3 + 3Na2SO4,
Rh (OH), + 6HCl = H3RhCl6 + 3H2O.
Далее, в слабокислой среде выделяют осадок гексанитроро-диата (III) натрия:
Н3[RhCl6] + 6NaNO2 = Na3[Rh (NO2)6] + 3NaCl + 3HCl
Действием соляной кислоты эту соль переводят в (NH4)3RhCl6, и, прокаливая последнюю, получают родиевую губку.
Рутений и иридий спекают с перекисью натрия при температуре 500° С. Выщелачивание спека дает раствор Na2RuO4 и остаток IrO2.
Четырехокись рутения отгоняют в токе хлора и поглощают раствором соляной кислоты. Добавляя хлористый аммоний, осаждают коричневые кристаллы (NH4)2RuCl6, которые после сушки восстанавливают в среде водорода с получением при 1000° С порошка рутения.
Двуокись иридия растворима в соляной кислоте. Действием хлорида аммония из раствора осаждают гексахлороиридат аммония, прокаливание его дает порошок иридия. Одна из схем переработки концентрата дана на рис.
Осмий часто встречается в виде сплава с иридием—осмистого иридия, на который царская водка практически не действует. При необходимости извлечения осмия нерастворимый остаток диспергируют плавкой с цинком и выщелачиванием соляной кислотой. Мелкий порошок спекают с ВаО2, обрабатывают спек смесью соляной и азотной кислот, а затем отгоняют осмий в виде весьма ядовитых паров OsO4.B поглотителе с раствором щелочи получают Nа2ОsО4, который восстанавливают тиосульфатом; и осмий осаждают в виде соли Фреми [OsO2(NH3)4]Cl2, при прокаливании она дает осмиевую губку.
Статья на тему Переработка концентратов платины

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.