Электропроводимость перенос ионов магния
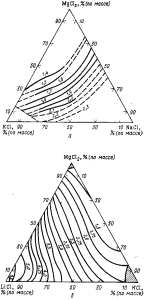
Рис. 87. Изотермы удельной электропроводимости расплавов при 700 °С (цифры у кривых — электропроводимость, 0,1 См/м: а —система КCl—NaCl—MgCl2; б —система LiCl— KCl-MgCl
Величины удельной электропроводимости индивидуальных солей при температурах немного выше точек их плавления приведены ранее. Наиболее высокие величины удельной электропроводимости имеют расплавленный NaCl и LiCl и наименьшую MgCl. Поэтому целесообразно для повышения электропроводимости иметь электролиты с высокими концентрациями NaCl и LiCl. С повышением температуры проводимость хлоридных расплавов увеличивается. На рис. 87 показано изменение удельной электропроводимости расплавов тройной системы КCl—NaCl—MgCl2 и LiCl—КCl—MgCl2 соответственно в зависимости от состава при 700°С. Максимальной электропроводимостью обладают расплавы тройной системы LiCl—КCl—MgCl2, содержащие более 60% LiCl и 10—20% MgCl2. Электропроводимость таких расплавов при 700 °С равна (4,2÷5,3) · 10-2 См/м. Применяемые в магниевой промышленности электролиты при этой температуре имеют электропроводимость порядка (1,7÷2,2) ·10-2 См/м. Отсюда следует, что применение «солей лития может дать существенный экономический эффект за счет интенсификации электролиза.
При изучении механизма переноса тока в расплавах системы КCl—MgCl2 было показано, что концентрация ионов магния возрастает у анода и убывает у катода, а концентрация ионов калия убывает у анода и увеличивается у катода. Данные о числах переноса ионов в расплавах системы КCl—MgCl2 приведены в табл. 18.
Таблица 18. Числа переноса ионов в расплаве системы KCl—MgCl2
| Числа переноса ионов | ||||
| Состав электролита | Температура, °C | К + | Mg2 + | Cl—(по разности) |
| KCl:MgCl2=l:l
KCl:MgCl2=2:l KCl:MgCl2=4:l KCl:MgCl2=2,5:l |
540—560
500—520 650—670 550 |
0,49
0,72 0,66 0,79 |
0,14
0,00 0,00 0,00 |
0,37
0,28 0,34 0,21 |
Ток к катоду переносится ионами калия и магния. С повышением концентрации КCl в расплаве доля тока, переносимая ионами магния, уменьшается. При концентрации MgCl2 меньше 28% (мол.) весь ток к катоду в основном переносится ионами калия.
Строение расплавов хлоридов щелочных металлов и хлорида магния
Электролиты магниевых ванн, которые состоят в основном из смеси расплавленных хлоридов калия и натрия с добавками хлорида магния, относятся к классу ионных жидкостей. В них находятся преимущественно отдельные ионы, хотя могут присутствовать также ион-но-ассоциированные группы и ионные пары.
Основными силами взаимодействия между частицами в таких расплавах являются электростатические: ион-ионные, ион-дипольные, диполь-дипольные.
В настоящее время еще не разработана до конца теория строения расплавленных солей, которая могла бы однозначно ответить на вопрос: из каких структурных частиц состоит тот или иной расплав, как происходит взаимодействие между отдельными частицами, какие изменения произойдут в расплаве при введении в него другой соли. Наибольшее признание получили две модели строения ионных расплавов: первая квазирешеточная, вторая — аутокомплексная. Согласно первой, ионный расплав рассматривается как несовершенный кристалл, в котором возможны различного рода дефекты: межузловое размещение ионов, образование свободных вакансий и т. д. Сравнение значений тепло-емкостей для одной и той же соли, находящейся в жидком и твердом состоянии вблизи ее точки плавления, показывает, что при плавлении теплоемкость увеличивается не более чем на 10%:
MgCl2 KMgCl3 K2MgCl,
Теплоемкость соли,Дж/(моль·К):
твердой…… 84,0 155,7 262,9
жидкой…… 92,4 168,0 283,8
Значения плотностей расплавленных и закристаллизовавшихся хлоридов тоже близки по своим величинам. Последнее объясняется тем, что объем соли растет с повышением температуры не в результате увеличения параметров «кристаллической решетки», а за счет роста числа дефектов в расплавленном ионном кристалле.
Исследования ионных расплавов с помощью рентгеновских лучей указывают на то, что при плавлении в этих расплавах сохраняется ближний порядок расположения частиц твердого кристалла и уменьшаются межионные расстояния. Полученные экспериментальные данные позволяют рассматривать ионные расплавы, особенно при температурах, близких к температурам их плавления, как жидкости, у которых сохранились основные элементы строения твердого кристалла, но имеющего большое число дефектов (вакансий).
Другая, аутокомплексная модель (М. В. Смирнов) представляет расплав как раствор вещества в себе самом. Согласно этой модели, часть катионов в расплавах галогенидов солей щелочных металлов являются центрами комплексов, в которые входят все галоген-ионы, а остальные катионы образуют вторую, более подвижную координационную сферу. Структура расплавов галогенидов щелочных металлов представляется в видеМеХ34—+Ме++пустоты, где Ме+— Ионы щелочных металлов. Обычно принимается, что первое координационное число 4, хотя предполагается, что оно может иметь и другие значения. Эта модель строения ионного расплава удобна для объяснения его транспортных свойств: коэффициентов диффузии, электропроводимости и др.
Точных данных о строении расплавленного MgCl2H его смесей с хлоридами других щелочных металлов нет. Предложенные в последнее время представления о структуре хлормагниевых расплавов в основном базируются на вышеприведенных моделях строения ионных расплавов и изученных физико-химических свойствах этих расплавов. Кристаллический MgCl2 имеет слоистую решетку. Предполагается, что MgCl2 в расплавленном состоянии в значительной мере сохраняет структурную упорядоченность, характерную для его кристаллической решетки в твердом состоянии. Диссоциация, возможно, протекает по следующей схеме:
MgCl2 ⇄ MgCl+ + Cl— ⇄ Mg2+ + 2Сl— .
С позиций аутокомплексной модели, расплавленный хлорид магния рассматривается как равновесная смесь ионов Mg2+, Сl— и MgCl24—:Mg2+ + 4Cl— ⇄ MgCl24— Концентрация катионов и анионов определяется величиной константы комплексообразования. При введении в расплав MgCl2 хлорида щелочного металла концентрация иона хлора увеличится и равновесие сдвинется вправо. На величину константы комплексообразования влияют ионы, находящиеся во второй координационной сфере. Известно, что хлорид-ионы взаимодействуют с ионами щелочных металлов, пытающимися «разрушить» комплеке, тем сильнее, чем меньше их ионный радиус. Отсюда, комплекс будет прочнее в том случае, когда во второй координационной сфере ион натрия замещается ионом калия.
Для системы MgCl2 с хлоридами других металлов, где при изучении диаграмм состояния установлено наличие химических соединений в твердом состоянии, предполагается, что и в расплавленном состоянии будут существовать соответствующие сложные комплексные ионы. Эти предположения подтверждаются данными, полученными при исследовании плотности, вязкости, поверхностного натяжения, электропроводимости, летучести, чисел переноса и других физико-химических свойств сложных расплавов. Так, было установлено нарушение монотонности хода кривых состав — свойство для расплавов КСl—MgCl2 и NaCl—MgCl2 в области экви-мольных составов. Отсюда можно предположить, что при расплавлении химические соединения KMgCl3 и NaMgCU диссоциируют по следующей схеме:
KMgCl3⇄ K+ + MgCl3— ⇄ K+ + MgCl+ + 2Сl— ⇄ K+ + Mg2+ + 3Cl—,
NaMgCl3 ⇄ Na+ + MgCl3— + Na+ + MgCl+ + 2Cl— ⇄ Na+ + Mg2+ + 3Cl—.
В расплавах данного состава ток переносится как ионами калия (натрия), так и ионами магния. По мере повышения содержания в расплаве КCl и NaCl доля тока, переносимая ионами магния, уменьшается, они связываются в малоподвижные комплексные анионы, и вероятная схема диссоциации уже будет такой:
K2MgCl4 ⇄ 2К+ + MgCl42- ⇄ 2К+ + MgCl3— + Cl— .
аналогично и для NaCl. Очевидно, при введении в расплав MgCl2 хлорида щелочного металла часть ионов Mg2+ будут замещаться ионами другого металла. Это приведет к усилению связи между ионами магния и хлора и, как следствие, к образованию комплексных ионов.
Прочность комплексов определяется концентрацией щелочного металла и радиусом его иона: чем больше радиус иона щелочного металла, тем сильнее комплексо-образование в расплаве. Радиус Na+ меньше радиуса К+, поэтому при равных концентрациях MgCl2 активность MgCl2 в расплаве КCl—MgCl2 значительно меньше, чем в расплаве NaCl—MgCl2. В системе RbCl— MgCl2 отрицательные отклонения от идеального состояния еще больше, чем в системе КCl—MgCl2, так как радиус Rb+ больше радиуса К+. В хлоридных расплавах, содержащих Mg+ и Rb+, комплексы магния будут еще прочнее, чем в расплавах КCl—MgCl2.
Таким образом, наличие ионов магния (Mg2+, Mg+) или его различных комплексных ионов (MgO24—, MgCl3—MgCl+) и их строение в хлормагниевых расплавах будет определяться силами сложного взаимодействия между отдельными частицами. На характер этих междуионных взаимодействий будет оказывать влияние химический состав расплава, концентрация отдельных компонентов в нем и температура.
Растворимость магния и хлора в электролите
В значительной мере потери магния в процессе электролиза хлоридных расплавов определяются взаимодействием металла с компонентами электролита. До сих пор нет единой точки зрения на механизм процесса растворения металлов в расплавленных солях, содержащих ионы этих же металлов. Большинство исследователей придерживаются мнения, что магний в хлоридных расплавах, содержащих MgCl2, растворяется за счет образования ионов низшей степени окисления.
Mg2+ ⇄ Mg ⇄ 2Mg+ , Mg2+ + Mg ⇄ Mg22+ .
Между магнием и его ионами в расплаве устанавливается равновесие. Сдвиг равновесия в ту или другую сторону и стабильная степень окисления ионов в расплаве зависит от строения внешних1 оболочек атомов изучаемого металла. Для магния это равновесие сдвинуто влево и устойчивыми в расплаве являются ионы с высшей степенью окисления. Установлено, что значение средней степени окисления ионов магния в расплавах КCl—NaCl—MgCl2 при 720—750°С составляет около 1,98—1,94.
Не исключается возможность растворения магния в расплавленных солях и в виде атомов с образованием истинного атомно-молекулярного раствора Mg—Mg°. Растворимость магния в жидком MgCl2 и в хлормагниевых расплавах при 700—850°С сравнительно невелика (табл. 19).
Таблица 19. Значения растворимости магния в хлоридных расплавах
| Состав расплава, % мол. | Температура, К | Растворимость магния на 1 моль расплава, г | ||
| MgCl2 | NaCl | KCl | ||
| 100 | 1023 | 10,2·10-2 | ||
| 100 | — | 1073 | 11,5·10-2 | |
| 100 | — | — | 1123 | 12,5·10-2 |
| 10,76 | 52,6 | 36,64 | 973 | 1,8·10-2 |
| 10,76 | 52,6 | 36,64 | 1023 | 2,2·10-2 |
| 10,76 | 52,6 | 36,64 | 1073 | 2,5·10-2 |
| 11,48 | 24,96 | 63,56 | 973 | 1,5·10-2 |
| 11,48 | 24,96 | 63,56 | 1023 | 1,7·10-2 |
| 11,48 | 24,96 | 63,56 | 1073 | 2,0·10-2 |
Из приведенной таблицы видно, что повышение температуры расплава увеличивает растворимость магния. При добавлении к расплавленному MgCl2 хлоридов щелочных (LiCl, КCl, NaCl) и щелочно-земельных (СаСl2, ВаСl2) металлов растворимость магния в расплаве падает. Наиболее сильно на растворимости магния сказываются добавки КCl и в меньшей степени — NaCl и LiCl. Это связано с понижением активности MgCl2 при добавлении КCl в расплав в большей степени, чем при добавлении NaCl и LiCl.
Введение в хлоридный расплав добавки NaF также снижает растворимость магния, что может быть объяснено образованием фторидных комплексов типа MgF24—и MgF3—. Фторидные комплексы более устойчивы, чем хлоридные, и тем самым снижают долю «свободного» MgCl2 в расплаве. Согласно первой реакции, растворимость магния в хлоридных расплавах должна уменьшаться прямо пропорционально корню квадратному из концентрации MgCl2, а согласно второй прямо пропорциональна содержанию MgCl2 в расплаве.
Потери магния также связаны с растворимостью хлора, выделяющегося на аноде, и с его диффузией в объем электролита. Вопрос о механизме растворения хлора в хлоридных расплавах пока остается дискуссионным. Эндотермический характер процесса растворения хлора в хлоридных расплавах и его малая растворимость говорят о физическом механизме растворения, аналогичном растворимости инертных газов в расплавах.
С другой стороны, результаты измерения показывают, что зависимость растворимости хлора в хлоридных расплавах системы NaCl—KCl от состава лишь незначительно отклоняется от линейной, а для систем KCl—MgCl2 и NaCl—MgCl2 эти отклонения велики, особенно в случае расплавов, содержащих KCl. Это, по-видимому, связано с тем, что растворение хлора в хло-ридных расплавах возможно также и за счет сольвата-ционного взаимодействия молекул газообразного хлора с хлор-ионами по реакции Сl2+Сl— ⇄ Сl3—
В системах, содержащих MgCl2, отклонения от линейной зависимости растворимости хлора от состава связано с образованием комплексных ионов, что ведет к уменьшению концентрации свободных ионов Сl— в расплаве. Равновесие вышеприведенной реакции сдвигается влево, уменьшая общую растворимость хлора. Косвенным подтверждением существования этой равновесной реакции является изменение окраски хлоридных расплавов при растворении в них хлора.
Растворимость хлора в чистом MgCl2 в интервале температур 750—900° С составляет около 0,6·10-6 моль/см3. Растворимость хлора в хлоридных расплавах растет с температурой, и эта зависимость описывается уравнением lgC·7=A—В/Т, где Т — абсолютная температура; А и В — эмпирические константы.
В расплавленных смесях хлоридов щелочных металлов и магния растворенные молекулы хлора не диссоциируют, так как растворимость хлора прямо пропорциональна парциальному давлению хлора над расплавом, т. е. подчиняется закону Генри.
Статья на тему Электропроводимость перенос ионов магния

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.