Из опыта известно, что в кристаллическом веществе физические свойства одинаковы в параллельных направлениях, а представление о строении веществ требует, чтобы слагающие кристалл частицы (молекулы, атомы или ионы) находились одна от другой на некоторых конечных расстояниях.
Исходя из этих предположений, возможно построить геометрическую схему строения кристаллического вещества. Для этого положение каждой слагающей частицы можно отметить точкой.
Вся кристаллическая постройка представится тогда системою точек, закономерно расположенных в пространстве, причем для любых параллельных направлений расстояния между точками будут одинаковыми.
Что такое структура кристаллов

Правильное расположение точек в пространстве называют пространственной решеткой, а если каждая точка представляет положение атома, иона или молекулы в кристалле — кристаллической решеткой.
Построение пространственной решетки можно себе представить следующим образом.
А0 (рис. 2) обозначает центр атома или иона.
Пусть ближайший к ней такой же центр обозначается точкой А0 тогда, на основании однородности кристаллического вещества, на расстоянии А1А2= А0А1 должен находиться центр А2 ; продолжая это рассуждение далее, можно получить ряд точек: А0, А1, А2, А3…
Положим, что ближайшая точка к А0 в другом направлении будет R0, тогда должна существовать частица S0 на расстоянии R0S0 = Л0R0и т. д., т. е. получится другой ряд одинаковых точек А0, R0, S0 … Если через R0, S0 и т. п. провести линии, параллельные A0, A1, A2, то получатся одинаковые ряды R0, R1, R2 ,S0, S1, S2… и т. д
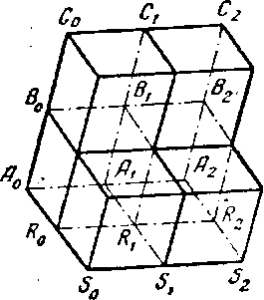
В результате сделанного построения получилась сетка, узлы которой соответствуют центрам частиц, слагающих кристалл.
Если далее принять, что в третьем направлении ближайшая к A0 частица находится вВ0, то следующая частица должна прийтись в С0 (В0С0 = А0В0) и т. д.
Если представить себе, что в каждой точке В0, Со и т. д. восстановлена такая же сетка, как и в A0, то в результате этого построения получится пространственная решетка, которая в известном смысле и будет выражать геометрическое строение кристаллического вещества.
Кристаллы это что
Теория пространственных решеток, созданная великим русским кристаллографом Е. С. Федоровым, получила блестящее подтверждение при исследовании структуры кристаллов посредством рентгеновских лучей.
Эти исследования дают не только картины пространственных решеток, но и точные длины промежутков между частицами, находящимися в их узлах.

При этом выяснилось, что существует несколько типов пространственных решеток, отличающихся как характером расположения частиц, так и химической природой их.
Отметим следующие типы пространственных решеток:
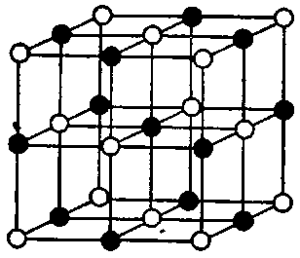
Атомные структурные решетки. В узлах этих решеток расположены атомы каких-либо веществ или элемента, соединяющиеся непосредственно между собою в кристаллическую решетку.
Такого типа решетка характерна для алмаза, цинковой обманки и некоторых других минералов (см. рис. 3 и 4).
Ионные структурные решетки. В узлах этих решеток расположены ионы, т. е. атомы, имеющие положительный или отрицательный заряд.
Ионные решетки обычны для неорганических соединений, например галогенов щелочных металлов, силикатов и пр.
Прекрасным примером является решетка каменной соли (NaCl) (рис. 5). В ней ионы натрия (Na) по трем взаимно перпендикулярным направлениям чередуются с ионами хлора (Сl) через промежутки, равные 0,28 миллимикрона .

В кристаллических веществах с подобной структурой промежутки между атомами в молекуле равны промежуткам между молекулами, и само понятие молекулы теряет смысл для таких кристаллов.
На рис. 5 каждый ион натрия имеет сверху, снизу, справа, слева, спереди и сзади на равных от него расстояниях по одному иону хлора, которые принадлежат как к данной «молекуле».
Так и к соседним «молекулам», и нельзя сказать, с каким именно ионом хлора из этих шести натрий составляет молекулу или составлял бы ее при переходе в газообразное состояние.
Кроме описанных выше типов, существуют молекулярные структурные решетки, в узлах которых находятся не атомы или ионы, а обособленные, электрически нейтральные молекулы.
Молекулярные решетки особенно характерны для различных органических соединений или, например, для «сухого льда» — кристаллической СO2.
Слабые («остаточные») связи между структурными единицами таких решеток обусловливают малую механическую прочность подобных решеток, их низкие температуры плавления и кипения.
Существуют и такие кристаллы, в которых сочетаются различные типы решеток. В одних направлениях связи частиц являются ионными (валентными), а в других молекулярными (остаточными).
Такое строение приводит к различной механической прочности в разных направлениях, обусловливая резкую анизотропию механических свойств.
Так, кристаллы молибденита (MoS2) легко раскалываются по направлению пинакоида (0001) и придают кристаллам этого минерала чешуйчатый облик, подобно кристаллам графита, где обнаруживается сходная структура.
Причиной малой механической прочности в направлении перпендикулярном (0001) является отсутствие в этом направлении ионных связей. Целостность решетки здесь удерживается только связями молекулярного (остаточного) характера.
Принимая во внимание все изложенное выше, легко провести параллель между внутренней структурой аморфного вещества, с одной стороны, и кристаллического, с другой:
- В аморфном веществе частицы располагаются в беспорядке, как бы закрепляя частично хаотическое состояние жидкости; поэтому некоторые исследователи называют аморфные вещества, например стекло, переохлажденными жидкостями.
- В кристаллическом веществе частицы располагаются в стройном порядке и занимают определенное положение в узлах пространственной решетки.
Различие между кристаллическим и стекловатым (аморфным) веществом можно сравнить с тем различием, которое имеется между дисциплинированной воинской частью и рассеянной толпой.
Естественно, что кристаллическое состояние более устойчиво, чем аморфное, и аморфное вещество будет легче растворяться, химически реагировать или плавиться.
Природные аморфные вещества всегда имеют тенденцию приобретать кристаллическое строение, «раскристаллизовываться», например опал (аморфный кремнезем) со временем переходит в халцедон — кристаллический кремнезем.
Вещество в кристаллическом состоянии обычно занимает несколько меньший объем, чем в аморфном виде, и имеет больший удельный вес.
Например альбит — полевой шпат состава NaAlSi3O8 в аморфном состоянии занимает 10 куб. единиц, а в кристаллическом—только 9; 1 см3 кристаллического кремнезема (кварца) весит 2,54 г,а такой же объем стекловатого кремнезема (сплавленного кварца) — только 2,22 г.
Особый случай представляет лед, имеющий меньший удельный вес, чем вода, взятая в том же количестве.
Исследование кристаллов рентгеновскими лучами
Вопрос о причинах закономерности в распределении физических свойств в кристаллическом веществе, вопрос о внутренней структуре кристаллов впервые пытался разрешить М. В. Ломоносов в 1749 г. на примере селитры.
Этот вопрос затем был более широко разработан уже в конце XVIII в. французским кристаллографом Аюи. Аюи высказал предположение, что каждому веществу свойственна определенная кристаллическая форма.
Это положение было в дальнейшем опровергнуто обнаружением явлений изоморфизма и полиморфизма. Указанные явления, играющие большую роль в минералогии, будут рассмотрены нами несколько позже.
Благодаря работам русского кристаллографа Е. С. Федорова и некоторых других кристаллографов, теория пространственных решеток, была разработана математически, и на основании исследования формы кристаллов были выведены возможные типы пространственных решеток.
Но только в XX в., благодаря исследованию кристаллов рентгеновскими лучами, эта теория была проверена на опыте и блестяще подтвердилась.
Целому ряду физиков: Лауэ, Брэггам, Г. В. Вульфу и др. удалось, используя теорию пространственных решеток, доказать совершенно точно, что в узлах кристаллических решеток находятся в одних случаях атомы, а в других молекулы или ионы.
Открытые Рентгеном в 1895 г. лучи, носящие его имя, представляют один из видов лучистой энергии и по многим свойствам напоминают лучи света, отличаясь от них только длиной волны, которая в несколько тысяч раз меньше длины световых волн.
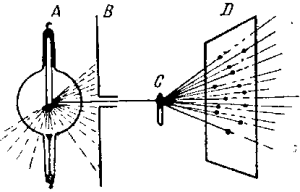
А — рентгеновская трубка; В — диафрагма; С — кристалл; D — фотопластинка
В 1912 г. Лауэ воспользовался кристаллом, где атомы расположены по пространственной решетке, как дифракционной решеткой для получения интерференции рентгеновских лучей.
В поставленном им исследовании узкий пучок параллельных рентгеновских лучей (рис. 6) пропускался через тонкий кристалл цинковой обманки С.
На некотором расстоянии от кристалла и перпендикулярно к пучку лучей была помещена фотографическая пластинка D, защищенная от непосредственного действия боковых рентгеновских лучей и от дневного света свинцовыми экранами.
При продолжительной выдержке в течение нескольких часов экспериментаторы получили картину, сходную с рис. 7.
Для световых лучей, обладающих сравнительно с размерами атомов большой длиной волны, атомные сетки пространственной решетки играют роль практически сплошных плоскостей, и световые лучи полностью отражаются от поверхности кристалла.
Гораздо более короткие рентгеновские лучи, отраженные от многочисленных атомных сеток, расположенных на определенных расстояниях друг от друга, идя по одному и тому же направлению, будут интерферировать, то ослабляя, то усиливая друг друга.
На фотографической пластинке, поставленной на их пути, усиленные лучи дадут при продолжительной экспозиции черные пятна, расположенные закономерно, в тесной связи с внутренним строением кристалла, т. е. с его атомной сеткой и с особенностями расположенных в ней отдельных атомов.
Если взять пластинку, вырезанную из кристалла в определенном кристаллографическом направлении, и произвести с ней тот же опыт, то на рентгенограмме будет виден узор, соответствующий симметрии строения кристалла.
Более плотным атомным сеткам соответствуют наиболее темные пятна. Редко усаженные атомами грани дают слабые точки или почти не дают их.
Центральное пятно на такой рентгенограмме получается от рентгеновских лучей, прошедших через пластинку
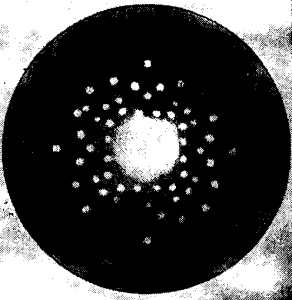
по прямому пути; остальные пятна образуют лучи, отраженные от атомных сеток.
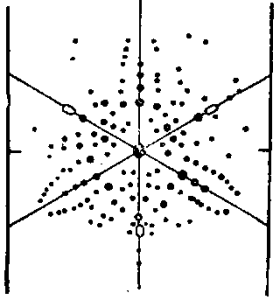
На рис. 7 изображена рентгенофотография кристалла каменной соли, из которого была вырезана пластинка около 3 мм толщиной, параллельная грани куба. Посредине видно большое пятно — след центрального пучка лучей.
Расположение мелких пятен симметрично и указывает на существование оси симметрии 4-го порядка и четырех плоскостей симметрии.
Вторая иллюстрация (рис. 8) изображает рентгенограмму кристалла кальцита.
Снимок сделан в направлении оси симметрии 3-го порядка. Буквами О обозначены концы осей симметрии 2-го порядка.
В настоящее время для исследования структуры кристаллических тел пользуются разными методами.
Существенной особенностью метода Лауэ, кратко описанного выше, является применение только крупных кристаллов, точно ориентированных по отношению к проходящему пучку рентгеновских лучей.
При невозможности пользоваться крупными кристаллами обычно применяется «метод порошков» (метод Дебая-Шерера).
Громадное преимущество этого метода в том, что для него не требуется крупных кристаллов.
Перед исследованием испытуемое вещество в тонко измельченном состоянии обычно спрессовывается в небольшой столбик.
Этим методом можно исследовать не только спрессованные порошки, но и вести работу над готовыми образцами металлов в виде проволоки, если кристаллики их достаточно мелки.
При наличии большого количества кристаллов отражение может произойти от любой грани каждого кристалла.
Поэтому на рентгенограмме, полученной по «методу порошков», обычно получается ряд линий, дающих характеристику исследуемого вещества.
Благодаря применению рентгеновских лучей для исследования кристаллов, наконец, была получена возможность проникнуть в область действительного расположения молекул, ионов и атомов внутри кристаллов и определить не только форму атомной решетки, но и расстояния между частицами, ее составляющими.
Изучение структуры кристаллов при помощи рентгеновских лучей позволило определить кажущиеся размеры ионов, входящих в состав данного кристалла.
Метод определения величины радиуса иона или, как обычно говорят, ионного радиуса будет ясен из следующего примера.
Исследование такого рода кристаллов как MgO, MgS и MgSe, с одной стороны, и MnO, MnS и MnSe, с другой, дало следующие межионные расстояния:
Для
MgO —2,10 Å МnО — 2,24 Å
MgS — 2,60 Å и MnS — 2,59 Å
MgSe — 2,73 Å MnSa — 2,73 Å,
где Å—обозначает величину „ангстрем», равную одной десятимиллионной миллиметра.
Сравнение приведенных величин показывает, что для межионного расстояния в соединениях MgO и МnО размеры ионов Mg и Мn Играют некоторую роль.
В других же соединениях видно, что расстояния между ионами S и Se не зависит от входящего в соединения другого иона, и ионы S и Se соприкасаются между собою, создавая плотнейшую упаковку ионов.
Вычисление дает для S-2 ионный радиус, равный 1,84 Å,
а для Se-2— 1,93 Å. Зная ионные радиусы S-2 и Se-2, можно вычислить и ионные радиусы других ионов. Так О 2имеет ионный
радиус, равный 1,32Å. F-1 — 1,33Å, Na+l —0,98Å, Са+2 — 1,06,
К+1— 1,33, Mg+2—0,78Å, Аl+3 —0,57Å, Si+4 — 0,39Å и т. д.
Величина ионного радиуса играет большую роль в вопросах изоморфизма и полиморфизма, что и будет рассмотрено в соответствующих разделах.
Рентгеноструктурное изучение минералов сильно продвинуло вперед современную минералогию, как в вопросах понимания строения минералов.
Так и связи их строения и состава с другими важными свойствами, как спайность, показатель преломления и др.
Значение исследования минералов рентгеновскими лучами прекрасно выражается следующей фразой:
«Если кристаллографы познавали минерал в той мере, в какой можно изучить здание, осматривая его снаружи, а химики пытались познать это здание, разрушив его и затем изучая в отдельности входившие в его состав материалы, то рентгеноструктурный анализ впервые позволил нам войти в здание и обозревать его внутреннее расположение и убранство».


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.