ОТКРЫТИЕ АТОМНОГО ЯДРА РЕЗЕРФОРДОМ
Однако в 1904 г. начались исследования, приведшие к утверждению планетарной модели. Уильям Брэгг (1862—1942) в Австралии, изучая прохождение α-частиц через вещество, нашел, что частицы не рассеиваются веществом, а поглощаются им, проходя в веществе до поглощения определенный прямолинейный отрезок — длину пробега. Одна из тем, выдвинутая Резерфордом в Манчестере — рассеяние α-частиц. Она была поручена Гейгеру и Марсдену.
Метод, применявшийся этими исследователями, заключался в следующем: α-частицы, испускаемые источником, диафрагмировались щелью и попадали на экран из сернистого цинка, на котором получалось изображение щели в виде узкой полоски. Затем между щелью и экраном помещали тонкую металлическую пластинку, изображение щели размывалось, что указывало на рассеяние α-частиц веществом пластинки. Исследуя угол рассеяния, Гейгер установил, что наиболее вероятный угол рассеяния пропорционален атомному весу и обратно пропорционален кубу скорости частицы.
Угол рассеивания
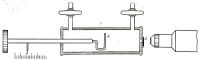
Рис. Установка Резерфорда no расщеплению ядра
Тонкая пластина отбрасывала частицы, летящие с большой скоростью. Как раз в том же 1909 г. Резерфорд и Ройдс неопровержимо доказали, что α-частицы являются дважды ионизированными атомами гелия. Для таких тяжелых быстро движущихся частиц рассеивание на углы, большие прямого, казалось весьма невероятным. Резерфорд говорил, что это так же невероятно, как если бы пуля отскакивала от листа папиросной бумаги.
Одно из возможных объяснений аномального рассеяния состояло в том, что оно складывается из многих небольших углов отклонений, вызванных атомами рассеивающего вещества.
Когда α-частица проходит мимо заряженного ядра, то под воздействием кулоновской силы, пропорциональной заряду ядра и заряду α-частицы и обратно пропорциональной квадрату расстояния между ними, она движется по гиперболе, удаляясь по ее ветви после прохождения мимо ядра. Ее прямолинейный путь, таким образом, искривляется, и она отклоняется на угол рассеяния Ф.
7 марта 1911 г. Резерфорд сделал в философском обществе в Манчестере доклад «Рассеяние α- и β-лучей и строение атома». В докладе он, в частности, говорил: «Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома α-и β-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала».
Расчеты угла рассевания материала
Резерфорд рассчитал вероятность такого отклонения и показал,что она пропорциональна числу атомов n в единице рассеивающего материала, толщине рассеивающей пластинки и величине b2, выражаемой следующей формулой:
b2 = 2NeE/mu2
где Ne — заряд в центре атома, е — заряд отклоняемой частицы, т — ее масса, и — ее скорость. Кроме того, эта вероятность зависит от угла рассеяния Ф, так что число рассеянных частиц на единицу площади пропорционально cosec4 Ф/2. Этот «закон косеканса» был проверен экспериментально Гейгером и был найден справедливым в пределах экспериментальных ошибок.
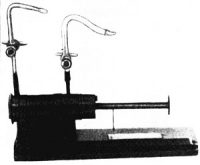
Рис. П. Л. Капица
В 1913 г. Гейгер и Марсден предприняли новую экспериментальную проверку формулы Резерфорда, подсчитывая рассеяние частиц по производимым ими сцинтилляционным вспышкам. «Это была трудная, кропотливая работа,— характеризовал Резерфорд работу своих сотрудников,— так как нужно было считать много тысяч частиц.
Результаты Гейгера и Марсдена весьма близко согласуются с теорией». Из этих утомительных и кропотливых исследований и возникло представление о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным (Резерфорд еще в 1913 г. считал знак заряда неопределенным) зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу.
Заряд ядра оказался важнейшей характеристикой атома. Бор вспоминал, что в 1912— 1913 гг. «в центре интересов всей манчестерской группы было исследование многочисленных следствий открытия атомного ядра». Далее он писал: «С самого начала было ясно, что благодаря большой массе ядра и его малой протяженности в пространстве сравнительно с размерами всего атома строение электронной системы должно зависеть почти исключительно от полного электрического заряда ядра. Такие рассуждения сразу наводили на мысль о том, что вся совокупность физических и химических свойств каждого элемента может определяться одним целым числом…»
Заряд ядра
В 1913 г. Ван ден Брук показал, что заряд ядра совпадает с номером элемента в таблице Менделеева. В том же 1913 г. Ф. Содди и К. Фаянс пришли к закону смешения Содди — Фаянса, согласно которому при α-распаде радиоактивный продукт смещается в менделеевской таблице на два номера выше, а при (3-распаде — на номер ниже. С точки зрения представления о номере элемента как о заряде ядра этот закон получает простое истолкование, К этому же времени Содди пришел к представлению об изотопах как разновидностях одного и того же элемента, ядра атомов которых имеют одинаковый заряд, но разные массы.
Заметим, что эта интерпретация пришла в голову Бору еще до того, как Содди и Фаянс открыли закон смещения чисто эмпирически. Бор не связывал ее с моделью атома Резерфорда. Эта же модель, все плодотворное значение которой было осознано Бором во время его пребывания в Манчестере, была положена им в основу первой квантовой модели атома. В богатом событиями 1913 г, были опубликованы три знаменитые статьи Бора «О строении атомов и молекул», открывшие путь к атомной квантовой механике.
Статья на тему Открытие атомного ядра



Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.