Механизм реакции обмена в растворах электролитов
Огромное число реакций, протекающих между электролитами в водных растворах, относится к типу реакций обмена. Рассмотрим механизм этих реакций несколько подробнее, причем будем считать, что сильные электролиты полностью диссоциированы.
В общем виде реакция обмена может быть выражена уравнением
АВ + CD = AD + СВ
Предположим, что АВ и CD — сильные электролиты и, следовательно, растворы их содержат исключительно свободные ионы А•, В’, С• и D’. Тогда результат реакции будет всецело зависеть от растворимости и способности к диссоциации образующихся веществ AD и СВ. Здесь возможны два основных случая: 1) образующиеся вещества тоже сильные электролиты, хорошо растворимые в воде, и 2) одно или оба образующихся вещества нерастворимы или являются слабыми электролитами.
Посмотрим на конкретных примерах, что происходит в том и другом случае.
Смешаем растворы двух сильных электролитов хлористого натрия NaCl и азотнокислого калия KNO3.Взаимодействие между ними в молекулярной форме выразится уравнением,
NaCl + KNO3 = NaNO3 + КСl
Так как соли NaNO3 и КСl хорошо растворимы в воде, то раньше считали, что эта реакция не доходит до конца и приводит к состоянию равновесия между взятыми и образующимися солями. Теперь мы знаем, что все четыре соли, как сильные электролиты, полностью диссоциированы на ионы. Поэтому, переходя к ионному уравнению реакции, можно написать:
Na• + Сl’ + K + NO3′ = Na• + NO3′ + К• + Сl’
Отсюда видно, что как до смешивания растворов, так и после него в растворе будут находиться только свободные ионы:
Na•, K• , Cl’ и NO3′
Таким образом, с точки зрения ионной теории в данном случае,?вообще не происходит никакой реак-ц и и. Этот вывод подтверждается и тем, что при смешивании растворов хлористого натрия и азотнокислого калия не наблюдается ни выделения, ни поглощения тепла, что указывает на отсутствие химического превращения.
Иначе обстоит дело, если одно из образующихся веществ является слабым электролитом. Рассмотрим, например, реакцию, происходящую при смешивании раствора уксуснокислого натрия NaCH3COO с раствором соляной кислоты:
NaCH3COO + НСl = СН3СООН + NaCl
До смешивания растворы содержали ионы Na•, СН3СОО’, Н• и Сl’, После смешивания ионы СН3СОО’, встречаясь в растворе с ионами Н• будут соединяться с ними, образуя недиссоцииро-ванные молекулы слабого электролита — уксусной кислоты СН3СООН. Это будет происходить до тех пор, пока в растворе не останется лишь такое число ионов Н• и СН3СОО’, которое соответствует степени диссоциации уксусной кислоты. В результате раствор будет содержать ионы Na•, СГ, молекулы СН3СООН и незначительное число ионов Н• и СН3СОO’. Пренебрегая последним, можно изобразить происходящую реакцию следующим ионным уравнением:
Н• + Сl’ + Na• + СН3СОО’ = Na• + Сl’ + СН3СООН
или, исключив ионы, не участвующие в реакции:
H• + CH3COO’ = CH3COOH
Следовательно, вся реакция сводится к образованию недиссоциированных молекул уксусной кислоты из ионов Н•и СН3СОО’. Такую реакцию называют вытеснением слабой кислоты из ее соли сильной кислотой, потому что при этой реакции сильная кислота (соляная) заменяется в растворе слабой кислотой (уксусной).
Другим примером реакции, при которой происходит образование слабо диссоциирующего вещества, является реакция нейтрализации сильных кислот сильными основаниями, например:
НСl + NaOH = NaCl + Н2O
Так как одно из образующихся при этой реакции веществ — вода — практически почти не диссоциирует на ионы, то, переходя к ионному уравнению, получаем:
H• + Cl’ + Na•+OH’ = Na• +Cl’ + H2O
Н• + ОН’ = Н2О
Последнее уравнение выражает процесс нейтрализации любой сильной кислоты любым сильным основанием на языке ионной теории. Следовательно, нейтрализация сводится к образованию молекул воды из ионов водорода (или гидроксония) и ионов гидроксила.
Если всякий процесс нейтрализации сильной кислоты сильным основанием состоит только в соединении водородных и гидроксильных ионов, то и количество выделяющегося при нем тепла всегда должно быть одно и то же, независимо от природы кислоты или основания. Опыт действительно подтверждает этот вывод: при нейтрализации любой сильной кислоты любым сильным осно-
ванием на каждую граммолекулу образующейся воды выделяется около 13,8 ккал тепла:
HCl + NaOH = NaCl + Н2O + 13,75 ккал
HNO3 + КОН = KNO3 + Н2O + 13,77 ккал
НСl + КОН = КСl + Н2O + 13,75 ккал
Реакции, аналогичные реакциям, протекающим с образованием слабого электролита, происходят и в тех случаях, когда одно из образующихся веществ нерастворимо и выделяется из раствора в виде осадка или в виде газа. Примером могут служить уже разобранные раньше реакции взаимодействия солей серебра с солями соляной кислоты, которые сводятся к образованию нерастворимого хлористого серебра из ионов серебра и хлора:
Ag• + Сl’ = AgCl
Правда, абсолютно нерастворимых веществ нет, поэтому при образовании хлористого серебра некоторое число ионов серебра и хлора, соответствующее произведению растворимости AgCl, остается в растворе. Поскольку это число ничтожно, мы при выражении реакции ионным уравнением им пренебрегаем. Так же точно мы поступаем и при составлении ионных уравнений других реакций, сопровождающихся образованием трудно растворимых веществ.
Разберем теперь, как будет протекать реакция, если одно из вступающих в реакцию веществ слабый электролит. Конечно, если вещества, которые могли бы образоваться в результате реакции, сильные электролиты, то никакой реакции не произойдет, как например, при смешивании растворов СН3СООН и KCl. Но если одно или оба образующиеся вещества еще более слабые электролиты, чем вступающий в реакцию электролит, то последний может почти целиком подвергнуться превращению. В качестве примера возьмем реакцию нейтрализации уксусной кислоты едким натром:
СН3СООН + NaOH = NaCH3COO + Н2O
Смешав растворы уксусной кислоты и едкого натра, мы получим раствор, который в первый момент будет содержать ионы Na• и ОН’ и небольшое число ионов Н• и СН3СОО’, находящихся в равновесии с недиссоциированными молекулами уксусной кислоты:
СН3СООН ⇄ Н• + СН3СОО’
При встрече ионы Н• и ОН’ будут соединяться, образуя молекулы практически недиссоциированной воды. По мере связыва-
ния ионов водорода равновесие между молекулами уксусной кислоты и ее ионами будет нарушаться и начнут диссоциировать новые молекулы. Этот процесс будет проходить до тех пор, пока почти все молекулы уксусной кислоты не распадутся на ионы.
Таким образом, в растворе будут одновременно протекать два процесса — диссоциация молекул уксусной кислоты и образование молекул воды из ионов водорода и гидроксила. Все происходящее можно представить в виде следующей схемы:
В данном, случае было бы неправильным изображать реакцию нейтрализации таким же ионным уравнением, как и реакцию нейтрализации сильных кислот сильными основаниями, т. е.
Н• + OH’ = H2O
так как свободных ионов водорода во взятом нами растворе почти не было, — они образовывались постепенно, по мере течения реакции, из молекул уксусной кислоты. Следовательно, молекулы уксусной кислоты косвенно тоже участвовали в реакции, поставляя все новые и новые ионы водорода по мере связывания последних гидроксильными ионами.
Чтобы отразить это обстоятельство в ионном уравнении, уксусную кислоту изображают в виде молекул, т. е. в том виде, в каком она главным образом и находилась во взятом нами растворе:
СН3СООН + Na• + ОН’ = Н2O + Na• + СН3СОО’
Произведя приведение подобных членов, получаем:
СН3СООН + OH’ = Н2O + СН3СОО’
Это уравнение не только отмечает косвенное участие в реакции молекул уксусной кислоты, но и показывает, что в результате резекции, кроме молекул воды, образовалось также большое число ионов СН3СОО’, которых до реакции в растворе почти не было.
Так как реакция нейтрализации уксусной кислоты (в отличие от реакции нейтрализации сильных кислот сильными основаниями) складывается из двух процессов — диссоциации молекул уксусной кислоты и образования молекул воды, то и теплота нейтрализации уже не равна 13,8 ккал, а составляет 13,3 ккал. Очевидно, что при диссоциации 1 моля уксусной кислоты поглощается 0,5 ккал тепла. В других случаях поглощение тепла при диссоциации слабого электролита может быть еще значительнее.
Например, при нейтрализации 1 моля хлорноватистой кислоты НСlO едким натром выделяется всего 9,84ккал.
Из разобранных примеров ионных реакций можно сделать следующий общий вывод:
Обязательным условием течения реакций обмена между электролитами является уход из раствора тех или иных ионов вследствие образования слабо диссоциирующих веществ, или веществ, практически нерастворимых, выделяющихся из раствора в виде осадка или газа. Иначе говоря, реакции в растворах электролитов всегда идут в сторону образования наименее диссоциированных или наименее растворимых веществ. Если ни одного из таких веществ при реакции образоваться не может, то не происходит и самой реакции.
Особого рассмотрения требуют еще реакции, при которых не только не образуются нерастворимые вещества, но, наоборот, нерастворимое в воде вещество растворяется при действии того или иного реактива.
В качестве примера возьмем хотя бы растворение гидрата окиси меди в кислотах:
Сu (ОН)2 + 2НСl = СuСl2 + 2Н2O
С первого взгляда может показаться, что эта реакция противоречит сделанному выше обобщению. Однако никакого противоречия здесь нет, так как одно из условий, определяющих направление реакции, именно образование мало диссоциированного соединения (воды), налицо; оно-то и является причиной растворения гидрата окиси меди.
Чтобы разобраться в происходящем процессе с точки зрения ионной теории, нужно прежде всего учесть, что нерастворимость вещества никогда не бывает абсолютной. Поэтому всякая жидкость над осадком «нерастворимого» вещества представляет собой насыщенный раствор этого вещества. В данном случае трудно сказать, содержит ли этот раствор только ионы Сu•• и ОН’ или также и недиссоциированные молекулы Сu (ОН)2,так как условия ионизации гидратов окислов тяжелых металлов еще мало изучены. Более вероятно, что такие гидраты образуют молекулярные решетки и, следовательно, при их растворении в раствор переходят молекулы, которые уже в растворе в большей или меньшей степени диссоциируют на ионы, В таком случае в насыщенном растворе гидрата окиси меди Сu(ОН)2 будут иметь место два связанных между собой равновесия: одно равновесие между осадком и перешедшими в раствор молекулами Сu(ОН)2, другое — между теми же молекулами и образовавшимися из них ионами:
Когда мы действуем на гидрат окиси меди кислотой, гидроксильные ионы связываются с водородными ионами кислоты в недиссоциированные молекулы воды. Убыль их тотчас же нарушает равновесие (2), вызывая диссоциацию нового числа молекул Сu (ОН)2, что, в свою очередь, нарушает равновесие (1), заставляя часть осадка перейти в раствор. Образовавшиеся вследствие диссоциации ионы гидроксила снова связываются с ионами водорода и так далее, пока при достаточном количестве кислоты весь осадок не перейдет в раствор. Все происходящее можно представить в виде следующей схемы:
Подобным же образом объясняется растворение осадков и других нерастворимых в воде электролитов.
Записывая эти реакции ионными уравнениями, мы должны изображать находящиеся в осадке электролиты как неионизиро-ванные вещества на том же основании, на каком изображали в виде молекул уксусную кислоту, разбирая реакцию ее нейтрализации едким натром. Поэтому реакция растворения гидрата окиси меди в соляной кислоте выразится следующим ионным уравнением:
Сu(OН)2 + 2Н• = Сu•• + 2Н2О
Итак, чтобы растворить трудно растворимый электролит, нужно связывать один из посылаемых им в раствор ионов . Чаще всего это достигается введением в раствор ионов, образующих с ионами электролита слабо диссоциирующее вещество.
Вы читаете, статья на тему Реакции обмена в растворах электролитов

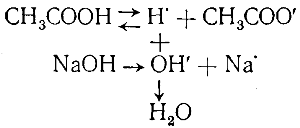

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.