Строение комплексных соединений
![Строение комплексных соединений Схема строения K2[PtCl6] Строение комплексных соединений Схема строения K2[PtCl6]](https://znaesh-kak.com/wp-content/uploads/2016/04/SAM_2135-1-300x187.png)
Знакомясь с элементами подгруппы меди, мы видели, что ионы этих элементов обладают способностью присоединять к себе другие ионы или нейтральные молекулы (например, NH3), образуя более сложные «комплексные» ионы. При испарении воды из растворов, содержащих комплексные ионы, последние связываются с находящимися в растворе бонами противоположного знака, и таким образом получаются различные «комплексные соединения».
Образование комплексных соединений, не может быть объяснено с точки зрения обычного учения о валентности. Состав их совершенно не согласуется с теми числами валентности, которыми мы пользуемся при составлении формул более простых «бинарных» соединений, т. е. соединений, состоящих только из двух элементов. Поэтому успешное изучение комплексных соединений стало возможным лишь после того, как в химию были введены некоторые новые представления о валентной связи. Эти представления легли в основу теории комплексных соединений, предложенной в 1893 г. профессором Цюрихского университета Альфредом Вернером (1866—1919) и получившей название к о о р д и н а ц и о н н о й т е о р и и.
Согласно координационной теории, в молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называется к о м-плексообразователем. Вокруг него в непосредственной близости расположено или, как говорят, координировано некоторое число противоположно заряженных ионов или электронейтральных молекул, называемых аддендами и образующих внутреннюю координационную сферу соединения. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу.
На рис. 147 схематически представлено строение комплексной соли K2[PtCl6]. (Комплексообразователем является здесь ион Pt4+, аддендами — ионы Сl—. Во внешней координационной сфере находятся ионы К+.
Чтобы отметить различие между внутренней и внешней сферами в формулах комплексных соединений, адденды вместе с комплексообразователем заключают в квадратные скобки.
При растворении комплексного соединения в воде ионы, находящиеся во внешней сфере, отщепляются. Поэтому связь их с центральным ионом называется ионогенной. Наоборот, ионы или молекулы, координированные во внутренней сфере (адденды), остаются связанными с центральным ионом, образуя прочный недиссоциирующий (или почти недиссоциирующий) комплекс. Например, соль K2[РtСl6] диссоциирует по уравнению
K2[PtCl6] = 2K• + [PtCl6]’
В большинстве случаев комплексные соединения образуются при взаимодействии веществ в водных растворах. Но иногда образование комплексных соединений может происходить и в других условиях. Так, например, безводный хлористый кальций непосредственно соединяется с аммиаком, превращаясь в комплексную соль [Са(NH3)8]Сl2.
Вопрос о том, какие из ионов, входящих в состав комплексного соединения, находятся во внутренней сфере и какие во внешней, решается путем изучения свойств данного соединения. Рассмотрим, например, как объясняет координационная теория структуру следующих комплексных соединений платины:
PtCl4•6NH3; PtCl4•4NH3; PtCl4• 2NH3; PtCl4 • 2KCl
Первое из этих соединений PtCl6 • 6NH3 — электролит, диссоциирующий в растворе на ионы. Если подействовать на его раствор нитратом серебра, то весь содержащийся в этом соединении хлор осаждается в виде хлористого серебра. Очевидно, что все четыре иона хлора, поскольку они легко отщепляются в растворе, находятся во внешней сфере соединения и, следовательно, внутренняя сфера состоит только из молекул аммиака. Этому соединению приписывают строение: [Pt(NH3)6Cl4.
Второе соединение PtCl4•4NH3 — тоже электролит, но электропроводность его раствора ниже, чем электропроводность раствора первого соединения, следовательно, оно образует меньше ионов. Нитрат серебра осаждает только половину хлора (т. е. два иона из четырех). Структура этого соединения должна бытьтакова: [Pt(NH3)4Cl2]Cl2. Так как во внешней сфере находятся только два иона хлора, то только они отщепляются в растворен осаждаются нитратом серебра. Остальные два иона хлора вместе с четырьмя молекулами аммиака входят в состав внутренней сферы и остаются в растворе связанными с ионом платины.
Третье соединение PtCl4 • 2NH3 — неэлектролит. Раствор его практически не проводит тока и не дает осадка с нитратом серебра. Отсюда приходится заключить, что все четыре иона хлора вместе с двумя молекулами аммиака входят в состав внутренней сферы. Строение этого соединения изображается формулой [Pt(NH3)2Cl4]. Так как во внешней сфере нет ни одного иона, то это соединение и не отщепляет ионов в растворе.
Наконец, последнее соединение PtCl4 • 2КСl, хотя и электролит, но из его растворов азотнокислое серебро не осаждает хлора. Путем обменных реакций можно установить, что в растворе имеются ионы калия. На этом основании строение рассматриваемого соединения изображается формулойК2[PtCl6]. Здесь все шесть ионов хлора находятся во внутренней сфере, внешнюю же сферу образуют два иона калия.
Для более наглядного представления о строении комплексных соединений их часто изображают развернутыми структурными формулами. Например:
Общее число нейтральных молекул и ионов, связанных с центральным ионом в комплекс, называется координационным числом комплексообразователя. Так, например, в приведенных выше соединениях платины координационное число комплексообразователя, т. е. иона Pt4+, равно 6.Координационное число играет в химии комплексных соединений не менее важную роль, чем число единиц валентности атома (иона), и является таким же основным его свойством, как и валентность. Величина координационного числа определяется главным образом размерами, зарядом и строением электронной оболочки комплексообразователя. Наиболее часто встречается координационное число 6, например: у железа, хрома, цинка, никеля, кобальта, четырехвалентной платины; координационное число 4 свойственно двухвалентной меди, трехвалентному золоту, двухвалентной ртути, кадмию. Встречаются иногда и другие координационные числа, но значительно реже (например, 2 для серебра и одновалентной меди).
Подобно тому как валентность элемента далеко не всегда проявляется полностью в его соединениях, так и координационное число комплексообразователя иногда может оказаться меньше обычного. Такие соединения, в которых характерное для данного иона максимальное координационное число не достигается, называются координационно ненасыщенными. Среди типичных комплексных соединений они встречаются сравнительно редко.
Заряд комплексного иона равняется алгебраической сумме зарядов составляющих его простых ионов. Например:
Ag• + 2CN’ = [Ag(CN)2]’ (+1-2 = -1) Pt••••+6Cl’ = [PtCl6]» (+4 — 6 = —2)
Входящие в состав комплекса электронейтральные молекулы, как-то: NH3, NO и др., не оказывают никакого влияния на величину его заряда. Поэтому при определении заряда комплексного иона их можно не учитывать. Если вся внутренняя координационная сфера образована только нейтральными молекулами, то заряд комплексного иона равен заряду комплексообразователя, например, заряд комплексного иона [Cu(NH3)4]••содержащего во внутренней сфере две электронейтральные молекулы аммиака, равен заряду иона меди Сu».
О заряде комплексного иона можно также судить по зарядам ионов, находящихся во внешней координационной сфере. Например, в соединении K4[Fe(CN)6] заряд комплексного иона [Fe(CN6]»» равен —4, так как во внешней сфере находятся четыре положительных однозарядных иона калия, а молекула в целом электронейтральна. Отсюда в свою очередь легко определить заряд комплексообразователя, зная заряды остальных содержащихся в комплексе ионов.
Нейтральные молекулы, находящиеся во внутренней координационной сфере комплексного соединения, могут быть последовательно замещены другими молекулами или отрицательными ионами. Например, путем замещения молекул аммиака в комплексной соли кобальта [Co(NH3)6]Cl3 ионами NO2‘ получают следующие соединения:
[Co(NH3)5NO2]Cl2; [Со (NH3)4(NO2)2Cl; [Со(NH3)3(NO2)3]; [Со(NH3)2(NO2)4] К; [Со(NH3)(NO2)5]К2; [Со(NO2)6]K3
Понятно, что при таком замещении постепенно изменяется и заряд комплексного иона, понижаясь от +3 у иона [Co(NH3)6]•• до —3 у иона [Co(NO2)6]»’.
Описанные выше соединения платины: [Pt(NH3)4Cl2]Cl2, [Pt(NH3)2Cl4] и K2[PtCl6] тоже можно рассматривать как продукты последовательного замещения молекул аммиака в [Pt(NH3)6]Cl‘4 двумя, четырьмя и, наконец, шестью ионами хлора.
Вы читаете, статья на тему Строение комплексных соединений

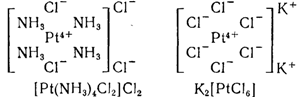
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.