Процесс диссоциации

Во время зарождения теории электролитической диссоциации атомы еще считались простейшими неделимыми частицами материи. Представление о сложной структуре атомов возникло значительно позже. Поэтому в то время трудно было понять, откуда появляются электрические заряды у частиц, образующихся при диссоциации электронейтральных молекул, и почему такой диссоциации подвергаются только молекулы кислот, основания и солей. Но с развитием учения о строении атомов и молекул оказалось возможным объяснить все эти явления.
В настоящее время мы знаем, что многие электролиты даже в твердом виде состоят из ионов. В гл. VI при рассмотрении внутреннего строения кристаллов было указано, что кристаллы солей построены не из молекул, а из отдельных положительно и отрицательно заряженных ионов, закономерно расположенных в узлах кристаллической решетки и удерживаемых в таком положении силами электростатического притяжения. Аналогичное строение имеют, по-видимому, и многие твердые основания. Естественно, что при растворении этих электролитов в воде ионы должны переходить в раствор как самостоятельные единицы, а не в виде нейтральных молекул, не существующих в твердом электролите.
Самый процесс распада кристаллов на отдельные ионы протекает, по-видимому, следующим образом. Молекулы воды обладают полярностью, т. е. представляют собой так называемые диполи. Когда кристалл какой-нибудь соли, например хлористого калия, попадает в воду, то расположенные у его поверхности ионы начинают притягивать к себе полярные молекулы воды (рис. 73). К ионам калия молекулы воды будут притягиваться своими отрицательными полюсами, а к ионам хлора — положительными. Но если ионы притягивают к себе молекулы воды, то и молекулы воды с такой же силой притягивают к себе ионы.
В то же время притянутые молекулы воды испытывают толчки со стороны других молекул, находящихся в движении. Этих толчков оказывается достаточно для отделения ионов от кристалла и перехода их в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой, и таким образом идет постепенное растворение кристалла.
Перешедшие в раствор ионы могут остаться связанными с молекулами воды, и тогда они образуют так называемые гидраты ионов. Существование таких гидратированных ионов во многих случаях доказано с несомненностью. Например, ион водорода всегда связан в растворе с одной молекулой воды, образуя гидроксониевый ион Н3О• Гидратированы в растворе и ионы многих металлов. Размеры катионов обычно меньше, чем размеры анионов; поэтому катионы сильнее притягивают молекулы воды. Чем меньше радиус катиона, тем меньше молекул воды входит в состав гидратированного иона. Небольшой катион бериллия Be•• образует тетрагидрат [Ве(Н2О)4]••; большие по размерам катионы Mg•• и Аl••• образуют гексагидраты [Mg(H2O)6]•• и [Аl(Н2O)6]•••; а такие большие катионы, как К• и другие, гидратированы еще сильнее.
Таким образом, в результате диссоциации образуются собственно не ионы, а соединения ионов с молекулами растворителя (гидраты ионов). Однако в уравнениях диссоциации ради упрощения большей частью пишут формулы ионов, а не их гидратов (или сольватов), тем более, что степень гидратации ионов, т. е. число связанных с ними молекул воды, далеко не всегда известна и может изменяться в зависимости от концентрации раствора и других условий.
В растворе ионы или их гидраты находятся в состоянии непрерывного беспорядочного движения. Сталкиваясь, они могут соединяться, образуя гидратированные молекулы, которые могут снова распадаться на ионы. Чем больше концентрация раствора, тем чаще происходят столкновения ионов. Поэтому в растворах, особенно концентрированных, наряду с ионами могут находиться и недиссоциированные молекулы.
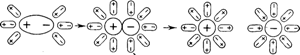
Распаду на ионы в водных растворах подвергаются не только вещества с ионными кристаллическими решетками, но и многие вещества, состоящие из молекул, если последние полярны. Схема диссоциации полярных молекул изображена на рис. 74. Молекулы воды, притянувшиеся к концам полярной молекулы, как бы растягивают последнюю, вызывая расхождение ее полюсов, вследствие чего она распадается на отдельные ионы. При этом, если положительным ионом является протон (т. е. ядро водорода), то он оказывается прочно связанным с молекулой воды в виде иона гидроксония Н3О•. Так, например, при растворении в воде хлористого водорода происходит химическая реакция, которая может быть выражена уравнением
Н2О + НСl = Н3O• + Сl’
При этой реакции полярная ковалентная связь между атомами водорода и хлора расщепляется таким образом, что пара электронов целиком остается у атома хлора, который превращается в ион Сl’, а протон, внедряясь в электронную оболочку атома кислорода в молекуле воды, образует ион гидроксония Н3O•.
Подобного же рода химическая реакция происходит и при растворении в воде других кислот, например азотной:
H2O + HNO3 = H3O• + NO3‘
Вы читаете, статья на тему Процесс диссоциации

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.