
Линейчатые спектры элементов Теория Бора
Ядерная модель атома Резерфорда получила свое дальнейшее развитие благодаря работам датского ученого Нильса Бора.
В которых учение о строении атома неразрывно связывается с учением о происхождении спектров.
Линейчатые спектры получаются при разложении света, испускаемого раскаленными парами или газами.
Каждому химическому элементу отвечает свой спектр, отличающийся от спектров других элементов.
Большинство металлов дает очень сложные спектры, содержащие огромное число линий (например, в спектре железа их насчитывается до 5000), но встречаются и сравнительно простые спектры.
Развивая ядерную теорию Резерфорда, ученые пришли к мысли,что сложная структура линейчатых спектров обусловлена происходящими внутри атомов колебаниями электронов.
По теории Резерфорда, каждый электрон вращается вокруг ядра, причем сила притяжения ядра уравновешивается центробежной силой, возникающей при вращении электрона.
Вращение электрона совершенно аналогично его быстрым колебаниям и должно вызывать испускание электромагнитных волн.
Поэтому можно предположить, что вращающийся электрон излучает свет определенной длины волны, зависящей от частоты обращения электрона по орбите.
Но, излучая свет, электрон теряет часть своей энергии, вследствие чего нарушается равновесие между ним и ядром.
Для восстановления равновесия электрон должен постепенно передвигаться ближе к ядру, причем так же постепенно будет изменяться частота обращения электрона и характер испускаемого им света.
В конце концов, исчерпав всю свою энергию, электрон должен «упасть» на ядро, и излучение света прекратится.
Если бы на самом деле происходило такое непрерывное изменение движения электрона, то и спектр получался бы всегда непрерывный, а не с лучами определенной длины волны.
Кроме того, «падение» электрона на ядро означало бы разрушение атома и прекращение его существования.
Таким образом, теория Резерфорда была бессильна объяснить не только закономерности в распределении линий спектра, но и самое существование линейчатых спектров.
Теория Бора строения атома

В 1913 г. Бор предложил свою теорию строения атома, в которой ему удалось с большим искусством согласовать спектральные явления с ядерной моделью атома.
Применив к последней так называемую квантовую теорию излучения, введенную в науку немецким физиком Планком.
Сущность теории квантов, сводится кто-му, что лучистая энергия испускается и поглощается не непрерывной струей, как принималось раньше.
А отдельными малыми, но вполне определенными порциями — квантами энергии.
Запас энергии излучающего тела изменяется: скачками, квант за квантом; дробное число квантов тело не может ни испускать, ни поглощать.
Величина кванта энергии зависит от числа колебаний излучаемой энергии: чем больше число колебаний, тем больше величина кванта.
Обозначая квант энергии через а в число колебаний через ν, можно написать:
ε = hν
где h — постоянная величина, так называемая константа: Планка, равная 6,624 • 10-27 эрг • сек.
Кванты лучистой энергии, называются также фотонами.
Применив квантовые представления к вращению электронов вокругядра, Бор положил в основу своей теории три очень смелых предположения, или постулата.
Хотя эти постулаты и противоречат законам классической электродинамики, но они:
Находят свое оправдание в тех поразительных результатах, к которым они приводят.
И в том полнейшем согласии, которое обнаруживается между теоретическими результатами и огромным числом экспериментальных фактов.
Постулаты бора спектр элемента
Постулаты Бора заключаются в следующем:
Электрон может двигаться вокруг ядра не по любым орбитам, а только по таким, которые удовлетворяют определенным условиям, вытекающим из теории квантов.
Эти орбиты получили, название устойчивых или квантовых орбит.
Когда электрон движется по одной из возможных для него устойчивых орбит, то он вовсе не излучает энергии.
Пользуясь законами элементарной механики, можно доказать, что запас внутренней энергии атома, состоящего из ядра и одного электрона, тем больше, чем дальше от ядра находится электрон.
При нормальном состоянии атома каждый электрон: находится на ближайший к ядру орбите и атом обладает наименьшим запасом энергии.
При сообщении атому энергии извне электрон может перейти на одну из более удаленных орбит.
Причем запас его энергии будет тем больше, чем дальше от ядра находится орбита, на которую он переходит.
Иначе это выражают, говоря, что такой-то электрон находится на более высоком энергетическом уровне.
Если внешнее воздействие достаточно велико, то электрон может быть совсем выброшен за пределы атома и атом превратится в ион.
Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии.
Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии.
Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона.
Обозначив запас энергии атома при положении электрона на более удаленной от ядра орбите через I2,
а на более близкой через I1 и разделив потерянную атомом энергию I2 — I1 на константу Планка, получим искомую частоту:
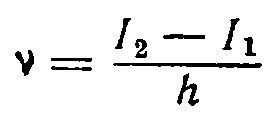
Чем больше расстояние от орбиты, на которой находится электрон, до той, на которую он переходит, тем больше частота излучения.
Простейшим из атомов является атом водорода, вокруг ядра которого вращается только один электрон.
Исходя из приведенных выше постулатов, Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел:
12 : 22 : 32 … n2
Величина п получила впоследствии название главного квантового числа.
Радиус ближайшей к ядру орбиты в атоме водорода равняется 0,53 ангстрема.
Вычисленные отсюда частоты излучений, сопровождающих переходы электрона с одной орбиты на другую.
Оказались в точности совпадающими с частотами, найденными на опыте для линий водородного спектра.
Тем самым была доказана правильность расчета устойчивых орбит, а вместе с тем и приложимость постулатов Бора для таких расчетов.
В дальнейшем теория Бора была распространена и на атомную структуру других элементов.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.