Константа диссоциации
Так как, по теории Аррениуса, электролитическая диссоциация является обратимой реакцией, приводящей к состоянию равновесия между недиссоциированными молекулами и ионами, то она подчиняется закону действия масс. Следовательно, можно вывести константу равновесия этой реакции совершенно так же, как это делается для других обратимых реакций. Возьмем, например, электролит, молекула которого XY диссоциирует на ионы X• и Y’ :
XY⇄X•+Y’
Обозначим концентрацию недиссоциированных молекул через [XY], а концентрации ионов через [X•] и [Y’]тогда при равновесии будем иметь:
Константа равновесия К называется в этом случае константой диссоциации. Величина ее характеризует способность электролита диссоциировать на ионы. Действительно, из предыдущего уравнения видно, что чем больше К, тем больше должны быть концентрации ионов при равновесии, т. е. тем сильнее диссоциирует электролит.
Между константой диссоциации и степенью диссоциации электролита существует определенная зависимость, позволяющая выразить одну величину с помощью другой. Если обозначить молярную концентрацию электролита, распадающегося на два иона, через С, а степень его диссоциации в данном растворе через а, то концентрация каждого из ионов будет Сα, а концентрация недиссоциированных молекул С (1— α). При таких условиях уравнение константы диссоциации принимает вид
Это уравнение выражает так называемый закон разбавления Оствальда и дает возможность вычислять степень диссоциации при различных концентрациях, если известна константа диссоциации электролита. Обратно, определив степень диссоциации при какой-нибудь концентрации, легко рассчитать константу диссоциаций. При расчетах концентрация недиссоциированных молекул выражается в граммолекулах (молях) на литр. Соответственно и концентрация ионов выражается в граммионах на литр.
Граммионом называется количество ионов, вес которых в граммах численно равен весу иона, выраженному в кислородных единицах. Например, граммион Сl’ равен 35,5 г, граммион ОН’ равен 17 г и т. д..
Константа равновесия не зависит от концентрации взятых для реакции веществ. Поэтому, если в растворе электролита действительно существует равновесие, о котором говорит теория Аррениуса, то величина константы диссоциации, для какой бы концентрации раствора мы ее ни вычисляли, должна оставаться постоянной. Попробуем сделать подобного рода расчет и таким образом проверить теорию Аррениуса.
Возьмем какой-нибудь слабый электролит, например уксусную кислоту, диссоциирующую по уравнению
CH3COOH ⇄ Н• + СН3СОО’
и вычислим для нее константу диссоциации, исходя хотя бы из 0,1 н. раствора. Степень диссоциации уксусной кислоты в 0,1 н. растворе равна 0,0132. Подставляя эти данные в уравнение константы равновесия
получаем:
Произведем аналогичный расчет для 0,01 н. раствора, где степень диссоциации равна 0,041:
Эти две величины; найденные нами для константы диссоциации уксусной кислоты, очень хорошо согласуются между собой. Согласуются они и с величинами, вычисленными для других концентраций уксусной кислоты. Следовательно, диссоциация уксусной кислоты — типичного слабого электролита — подчиняется закону действия масс.
Совершенно иная картина получается для растворов сильных электролитов. В качестве иллюстрации приводим результаты вычислений константы диссоциации хлористого калия для растворов различной концентрации (табл. 12).
Здесь уже величина К не является константой, так как она не остается постоянной, но возрастает с увеличением концентрации раствора. Изменяемость величины К характерна не только для хлористого калия, но и для любого сильного электролита.
Таблица 12. Диссоциация хлористого калия при 18°
| Концентрация КСl | α | К |
| 2 н.
1 н. 0,5 н. 0,1 н. 0,01 н. |
0,712
0,756 0,788 0,862 0,942 |
3,52
2,34 1,46 0,536 0,152 |
Отсюда видно, что к сильным электролитам закон действия масс не приложим.
Таким образом, в случае слабых электролитов теория Аррениуса вполне согласуется с экспериментальным данными; для сильных же электролитов в нее должны быть внесены существенные поправки.
Вы читаете, статья на тему Константа диссоциации

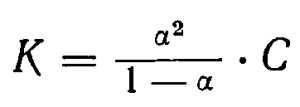
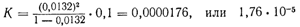
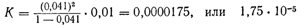
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.