Заряды ядер Закон Мозли
Прежде всего напомним, что представляют собой обыкновенные оптические спектры, т. е. спектры «сводимого» света.
Если плоский пучок белого света, испускаемого раскаленным твердым телом, пропустить сквозь стеклянную призму, то на поставленном за призмой экране получается так называемый сплошной спектр в виде цветной полосы, содержащей все цвета радуги от красного до фиолетового в непрерывной последовательности.
Это явление, как известно, объясняется тем, что белый свет состоит из цветных лучей различной длины волны, которые,проходя сквозь призму, неодинаково отклоняются ею и, падая на различные места экрана, образуют спектр.
Получения спектра для определения заряда
Для получения спектра вместо призмы можно воспользоваться дифракционной решеткой. Последняя представляет собой стеклянную пластинку, на поверхности которой алмазом, на очень близком расстоянии друг от друга, нанесены тонкие параллельные штрихи (до 1500 штрихов на 1 мм). Эти непрозрачные штрихи играют роль «прутьев» решетки.
Проходя сквозь такую решетку, свет разлагается и образует спектр, аналогичный полученному при помощи призмы, но с обратным порядком р ас положения цв тов.
Раскаленные твердые тела или жидкости всегда дают сплошной спектр. Совершенно иная картина наблюдается при разложении света, испускаемого раскаленным газом или паром. Их свет содержит в себе только некоторые определенные лучи.
Поэтому вместо сплошной цветной полосы на экране получается ряд отдельных цветных линий, разделенных темными промежутками. Число,окраска и расположение этих линий зависят от природы раскаленного газа или пара. Так, например, пары металла калия дают спектр,состоящий из трех линий — двух красных и одной фиолетовой; в спектре паров кальция несколько красных, желтых и зеленых линий ит. д. Такие спектры называются прерывистыми или линейчатыми.
Изучение спектров
Для изучения оптических спектров существуют особые приборы— спектроскопы и спектрометры. Последние позволяют не только наблюдать число и расположение линий спектра, но и измерять длину волн соответствующих лучей.
Перейдем теперь к рассмотрению спектров рентгеновых лучей и тех выводов, к которым привело их изучение.
Как мы уже говорили, рентгеновы лучи возникают при ударе быстро летящих электронов о какое-либо твердое тело и отличаются отлучей видимого света только значительно меньшей длиной волны. В то время как самые короткие световые волны имеют длину около 4000 ангстремов (фиолетовые лучи), длины волн рентгеновых лучей лежат впределах от 20 до 0,1 ангстрема.
Чтобы получить спектр рентгеновых лучей, нельзя пользоваться обыкновенной призмой или описанной выше дифракционной решеткой. Теоретически для лучей с такой короткой длиной волны,как рентгеновы лучи, нужно было бы приготовить дифракционную решетку с 1 000 000 делений на 1 мм. Так как искусственно приготовить такую решетку невозможно, то долгое время спектр рентгеновых лучей не удавалось получить.
В 1912 г. у швейцарского физика Лауэ возникла мысль использовать кристаллы в качестве дифракционной решетки для рентгеновых лучей. Закономерное расположение атомов в кристаллах и весьма малые расстояния между ними давали основание предполагать, что кристалл как раз и может сыграть роль требуемой дифракционной решетки. Опыт блестяще подтвердил предположение Лауэ, и вскоре удалось построить приборы, которые давали возможность получать спектры рентгеновых лучей почти всех элементов.
Для получения рентгеновых спектров антикатод в рентгеновых трубках делают из того металла, спектр которого желают исследовать, или же наносят на платиновый антикатод какое-нибудь соединение исследуемого элемента. Экраном для спектра служит фотографическая пластинка или бумага; после проявления на ней отчетливо выступают все линии спектра.
Рентгеновы спектры отличаются от линейчатых спектров паров и газов своей простотой. Спектр каждого элемента состоит из нескольких линий или групп линий, обозначаемых как К—L—М-серии, расположение которых для различных элементов совершенно аналогично. Влияние луче испускающего вещества сказывается лишь в длинах волн спектральных линий.
Закон Мозли
В 1913 г. английский ученый Мозли, изучая рентгеновы спектры, нашел, что с увеличением порядковых номеров элементов, т. е. чисел, показывающих, какое по счету место занимает тот или иной элемент в периодической системе, линии каждой серии закономерно смещаются в сторону убывающих длин волн.
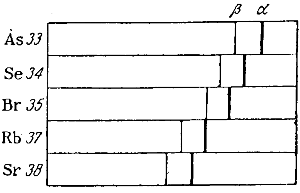
На рис. 20 показано смещение двух наиболее ярких линий α и β серии К для ряда элементов от мышьяка до стронция. Из рисунка видно, что для первых трех элементов смещение приблизительно одинаково. При переходе от брома (№ 35) к рубидию (№ 37)наблюдается вдвое большее смещение, свидетельствующее о пропуске одного элемента.
Соотношение между длинами волн рентгеновых лучей и порядковыми номерами соответствующих элементов носит название закона Мозли и может быть сформулировано следующим образом:
Корни квадратные из обратных значений длин волн находятся в линейной зависимости от порядковых номеров элементов.
Это означает, что если на оси абсцисс отложить порядковые номера элементов, а на оси ординат корни квадратные из обратных значений длин волн, то зависимость между ними изобразится графически прямой линией.
Открытие Мозли сыграло очень важную роль при выяснении строения атомов. Тесная связь между рентгеновыми спектрами элементов и их порядковыми номерами указывала на то, что порядковые номера не просто регистрируют положение элементов в периодической системе, но имеют определенный физический смысл т. е. выражают какое-то свойство атомов.
Еще до работ Мозли некоторые теоретические соображения позволяли предположить, что порядковый номер элемента указывает число положительных зарядов ядра его атома. В то же время Резерфорд, изучая рассеяние α-частиц при прохождении сквозь тонкие металлические пластинки, нашел, что если заряд электрона принять за единицу, то выраженный в таких единицах заряд ядра приблизительно равняется половине атомного веса элемента.Порядковый номер, по крайней мере более легких элементов, тоже равняется примерно половине атомного веса. Bсe вместе взятое привело к выводу, что заряд ядра численно равен порядковому номеру элемента.
Этот вывод был окончательно подтвержден в 1920 г. английским физиком Чэдвиком путем непосредственного измерения зарядов атомов меди, серебра и платины.
Принимая во внимание неизбежные погрешности опыта,совпадение полученных чисел с порядковыми номерами элементов нужно признать очень хорошим. Таким образом, закон Мозли позволил определить заряды атомных ядер. Тем самым, ввиду нейтральности атомов, было установлено и число электронов, вращающихся вокруг ядра в атоме каждого элемента.


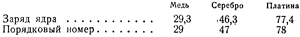
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.