Диссоциация воды
Одним из наименее диссоциированных веществ, образующихся при реакциях между ионами, является вода. Чистая вода очень плохо проводит электрический ток, но все же обладает некоторой измеримой электропроводностью, которая объясняется небольшой диссоциацией воды на водородные и гидроксильные ионы:
H2O ⇄ H + OH’
По величине электропроводности чистой воды можно вычислить концентрацию ионов водорода и ионов гидроксила в воде. Она оказывается равной 10-7 г-ион/л.
Применяя к диссоциации воды закон действия масс, можно написать:
Перепишем это уравнение следующим образом:
[H•] • [ОН’] = [Н2O] • K
Так как степень диссоциации воды очень мала, то концентрацию недиссоциированных молекул Н2О не только в воде, но и во всяком разбавленном водном растворе можно считать величиной постоянной. Поэтому, заменив [Н2O] • K новой константой КН2О, будем иметь:
[Н•] • [ОН’] = КH2O
Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной температуре произведение концентраций водородных и гидроксильных ионов есть величина постоянная. Эта постоянная величина называется ионным произведением воды. Численное значение ее нетрудно получить, подставив в последнее уравнение концентрации водородных и гидроксильных ионов
КH2O = 10-7 • 10-7 = 10-14
Растворы, в которых концентрация водородных и концентрация гидроксильных ионов одинаковы и равны каждая 10—7 г-ион/л, называются нейтральными растворами. В кислых растворах больше концентрация водородных ионов, в щелочных — концентрация гидроксильных ионов. Но какова бы ни была реакция раствора, произведение концентраций H• и ОН’-ионов должно оставаться постоянным.
Если, например, к чистой воде прибавить столько кислоты, чтобы концентрация водородных ионов повысилась до 10-3, то концентрация гидроксильных ионов должна будет понизиться так, чтобы произведение [Н•] • [ОН’] осталось равным 10-14. Следовательно, в этом растворе концентрация гидроксильных ионов будет:
[OH] = 10-14 : 10-3 = 10-11
Наоборот, если прибавить к воде щелочи и тем повысить концентрацию гидроксильных ионов, например, до 10-5, то концентрация водородных ионов станет равна:
[H•] = 10-14 : 10-5 = 10-9
Вы читаете, статья на тему Диссоциация воды

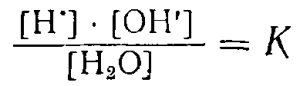
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.