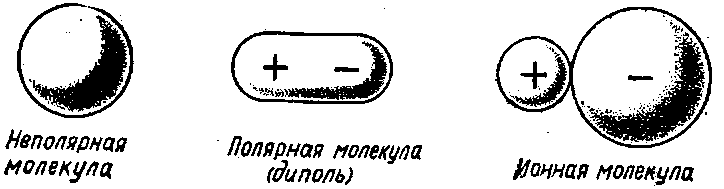
Рис. Типы простейших молекул.
Типы простейших молекул
Так как каждая молекула состоит из положительно заряженных ядер и отрицательно заряженных электронов, то в занимаемом ею объеме всегда можно найти такие две точки, которые являются электрическими «центрами тяжести» положительных и отрицательных зарядов.
Если эти две точки совпадают, молекула называется неполярной или электрически симметричной (Н2, O2, СН4).
При несовпадении электрических «центров тяжести» положительных и отрицательных зарядов молекула называется полярной или диполем (НСl, СО).
Диполь — это система, имеющая два различных по величине, но противоположных по знаку электрических заряда, расположенных на некотором расстоянии друг от друга.
При очень резком расхождении электрических «центров тяжести» молекула состоит из противоположных зарядов.
В этом случае говорят, что она построена по ионному типу (рис. 1).
Чтобы количественно охарактеризовать полярность молекул, пользуются величиной дипольного момента μ.
Который представляет собой произведение расстояния r между центрами электрических зарядов на величину заряда q положительного конца диполя:
μ = r • q
За единицу измерения дипольного момента принимают один дебай (D), равный 3,3•10-30 кл•м (см. ниже).
Дипольные моменты двухатомных молекул
| Молекула | Дипольный момент, D |
| Сl2 | 0 |
| СО | 0,12 |
| HF | 1,82 |
| НСl | 1,07 |
| НВl | 0,79 |
| HI | 0,38 |
Дипольный момент является векторной величиной; его изображают стрелкой, направленной от плюса к минусу.
Чем выше дипольный момент молекулы, тем больше ее полярность.
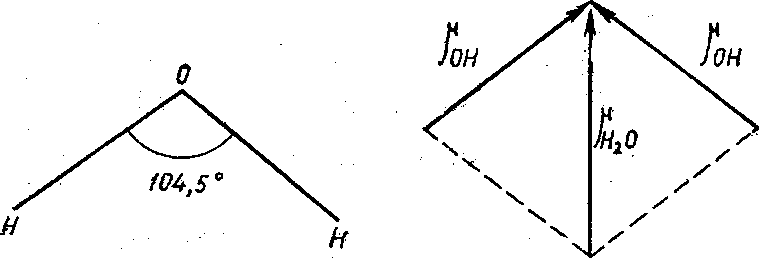
Рис. 2. Векторная сумма дипольных моментов связей О—Н в молекуле воды
Полярность двухатомных молекул полностью определяется полярностью химической связи между атомами.
Дипольный момент таких молекул совпадает по величине и направлению с дипольным моментом химической связи.
Полярность многоатомных молекул зависит не только от природы отдельных химических связей, но и от их пространственного расположения, а также от наличия не поделенных пар электронов у отдельных атомов.
Многие симметрично построенные молекулы сложных веществ неполярные, в то время как химические связи между атомами полярные.
Пример простейших молекул
Например, молекула оксида углерода (IV) имеет линейное строение; дипольные моменты двух связей С = 0 равны по величине, но противоположны по направлению, поэтому результирующий дипольный момент молекулы равен нулю.
В молекуле воды угол между направлениями связей О—Н равен 104,5°, поэтому ее результирующий момент направлен по диагонали параллелограмма и отличен от нуля (рис. 2).
Статья на тему Типы простейших молекул

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.