Растворы это жидкости способны растворять в себе другие жидкости, газы и твердые вещества, образуя однородные смеси — растворы.
Если растворенное вещество находится в виде отдельных молекул или других частиц, имеющих столь же малые размеры, то раствор называется молекулярным, истинным или просто раствором.
Особый интерес представляют собой водные растворы, поскольку они играют ведущую роль в физиологических, почвенных, технологических процессах и, кроме того, широко распространены в природе.
Истинные растворы и процесс растворения: сольватация и гидратация
Растворение нельзя рассматривать как чисто физический процесс диффузии подобно смешению газов; оно происходит в результате сольватации — взаимодействия частиц растворяемого вещества с молекулами растворителя.
Если растворителем является вода; процесс сольватации называют гидратацией. Продукты взаимодействия частиц вещества с растворителем называют соответственно сольватами или гидратами.
Основоположником сольватной теории является Д. И. Менделеев, который еще в шестидесятых годах прошлого века выдвинул предположение о существовании нестойких химических соединений растворенного вещества с водой.
При выделении твердых соединений из раствора гид-ратная вода часто входит в состав кристаллов, образуя кристаллогидраты, например:
CuSO4 • 5H2O,FeSO4 • 7H2O, Na2CO3 • 10Н2О
Прочность связи кристаллизационной воды различна: медный купорос обезвоживается лишь при достаточно сильном нагревании, в то время как мирабилит
Na2SO4 • 10H2O
уже на воздухе постепенно теряет кристаллизационную воду, превращаясь в безводный сульфат натрия.
Образование раствора сопровождается разрушением связей между отдельными частицами в структуре растворителя и растворяемого вещества.
Этот процесс энергетически невыгоден. Однако сопровождающий его процесс сольватации приводит к высвобождению теплоты.
Суммарный энергетический эффект растворения может быть поэтому как больше, так и меньше нуля.
При растворении жидкостей и газов, характеризующихся относительно слабыми связями между молекулами, тепловой эффект, как правило, положителен.
Растворение твердых веществ
Теплота растворения твердых веществ зависит от природы и структуры кристаллов. В одних случаях (например, при растворении гидроксида натрия в воде) этот эффект значительно больше нуля, в других же — он отрицателен (растворение нитрата аммония в воде).
Если образование раствора сопровождается выделением тепловой энергии, то с повышением температуры растворимость вещества падает.
В случае, когда растворение вещества происходит с поглощением теплоты, возрастание температуры увеличивает его растворимость.
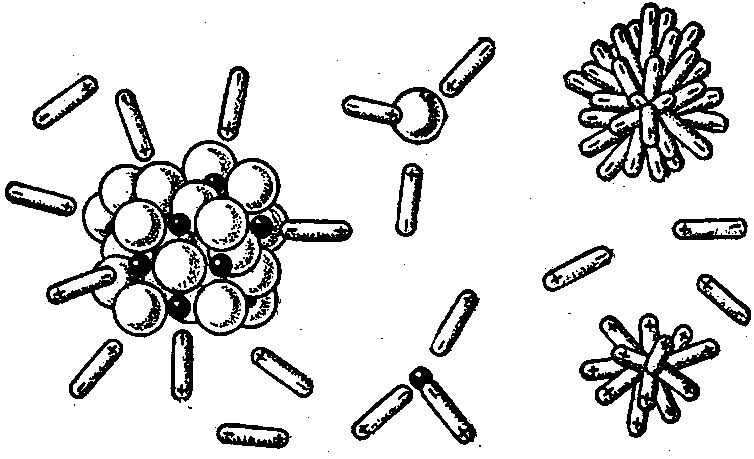
При растворении ионных соединений в воде или других высокополярных жидкостях кристаллы разрушаются и образуются гидратированные ионы (рис.).
Для хлорида натрия этот процесс можно представить в виде следующей схемы:
(Кристалл хлорида натрия) Na+nCl—n +п(х+у)Н2О → n[Na +(Н2О)x+Cl—(Н2O)у] (Раствор хлорида натрия в воде)
Энергия взаимодействия ионов с молекулами вод довольно значительна. Она составляет обычно 102— 103 кдж/моль (таблице), причем катионы гидратируются сильнее анионов.
Большинство ионов образует гидраты переменного состава, а в некоторых случаях число связанных молекул воды вообще не удается определить.
Поэтому при составлении уравнений химических реакций используют упрощенные схемы и не учитывают явление гидратации. Вместо Сu(Н2О)23+пишут обычно Сu2+, вместо Ве(Н2O)24+ — Ве2+ и так далее.
Энергия гидратации некоторых ионов Таблица
| Ион | Энергия гидратации, кдж/моль | Ион | Энергия гидратации, кдж/моль |
| Li+ | 521 | F— | 506 |
| Na+ | 406 | Сl— | 363 |
| К+ | 322 | Вr— | 336 |
| Rb+ | 301 | I— | 295 |
| Mg2+ | 1922 | он— | 239 |
| Ва2+ | 1360 | ClO4— | 460 |
| Sc3+ | 2640 |
Растворимость газообразных, жидких и твердых веществ
В процессе растворения твердого вещества в воде или какой-либо другой жидкости частицы поверхностного слоя переходят в растворитель и в результате диффузии постепенно распределяются по всему объему жидкости.
Затем в раствор переходит новый слой ионов и так далее.
Одновременно происходит обратный процесс: сольватированные частицы, оказываясь в непосредственной близости от поверхности кристалла, теряют свои оболочки и вновь входят в состав кристалла.
Увеличивая концентрацию вещества, можно добиться такого состояния, когда в единицу времени на поверхности всех кристаллов будет выделяться столько же частиц, сколько их переходит в раствор, который в этом случае называется насыщенным, азы и жидкости тоже образуют насыщенные растворы.
Количество вещества, содержащееся в насыщенном растворе, определяет растворимость вещества при данных условиях.
Растворимость газов
Растворимость газов в жидкостях очень различна. Например, при комнатной температуре 1 л воды способен поглотить 31 мл кислорода или 700 л аммиака.
Большинство газов растворяется в неполярных и малополярных жидкостях лучше, чем в воде.
Исключение составляют галогеноводороды и аммиак. При нагревании растворимость газообразных веществ, как правило, уменьшается.
Кипячением жидкостей удается практически полностью освободить их от растворенных газов.
Наличие в воде растворенных солей заметно снижает растворимость газообразных веществ.
Количественно эта закономерность выражается формулой Сеченова:
S = S0e-кс,
где S0— растворимость газа в воде; S — растворимость газа в растворе с концентрацией с; е — основание натуральных логарифмов; к — постоянная, зависящая от температуры, а также от природы газа и соли.
На растворимость газообразных веществ большое влияние оказывает давление.
При постоянной температуре растворимость газа в жидкости прямо пропорциональна внешнему давлению (закон Генри). При растворении газовых смесей растворимость каждого газа прямо пропорциональна его парциальному давлению (закон Дальтона).
Последнюю закономерность можно проиллюстрировать на следующем примере: вода при соприкосновении с воздухом поглощает столько же кислорода, сколько она растворила бы его, соприкасаясь с чистым кислородом, находящимся под давлением 0,2 • 105 Па (парциальное давление кислорода в воздухе).
Растворимость жидкостей в жидкостях
При растворении жидкостей в жидкостях также могут быть самые различные случаи.
Например, этиловый спирт, молекулы которого способны образовывать прочные водородные связи, смешивается с водой в любых отношениях, в то время как вода и бензол практически нерастворимы друг в друге.
Растворимость жидкостей в жидкостях зависит от их природы, температуры и давления. С повышением температуры она чаще всего увеличивается.
Растворимость твердых соединений очень сильно колеблется для различных растворяемых веществ и растворителей. При увеличении температуры она обычно возрастает. Из этого правила есть однако множество исключений.
Так, например, растворимость сульфата кальция в воде, начиная с 35 С, не увеличивается, а падает, что является одной из причин образования плотных слоев накипи в паровых котлах.
Систематическое исследование растворимости твердых веществ в зависимости от температуры было впервые предпринято М. В. Ломоносовым в середине XVIII в.
Другой русский ученый — Т. Е. Ловиц изучил условия получения и устойчивость пересыщенных растворов, существование которых объясняется трудностью первоначального возникновения центров кристаллизации.
Любой процесс, связанный с формированием кристаллов, включает в себя первоначальное образование зародышей или центров кристаллизации.
Поскольку этот процесс относится к микромиру, он носит в большой степени случайный характер.
Приведем в доказательство один пример. Всем хорошо известен глицерин — вязкая жидкость, применяемая для смягчения кожи, изготовления парфюмерных изделий и ликеров. Его температура плавления равна 18°С. Однако редко кому удавалось видеть твердый глицерин. Даже будучи выставлен на сильный мороз, он обычно не замерзает.
Мало того, можно в течение нескольких дней держать нижний конец пробирки с глицерином в жидком воздухе и все равно кристаллы могут не образоваться. Достаточно, однако, внести в глицерин, находящийся при температуре ниже 18°С, маленький его кристаллик, чтобы вся жидкость быстро превратилась в твердое тело. В связи с этим интересным является случай, описанный химиком И. Лэнгмюром.
В Канаде много лет работал глицериновый завод, обслуживающий персонал которого ни разу не сталкивался с проблемой кристаллического глицерина. И вот однажды зимой, внезапно, хотя держалась и не очень низкая температура, замерзли трубы, подводящие глицерин от одного аппарата к другому. Вся территория завода и даже пыль на почве оказались «заражены» мельчайшими кристалликами глицерина.
И хотя любая часть трубопровода могла быть освобождена от кристаллов с помощью нагревания, замерзание тут же происходило в другом месте. Весь завод пришлось на несколько месяцев остановить, пока внешняя температура не поднялась выше 18°С.
Структура жидких растворов
Помимо теплового эффекта, растворение часто сопровождается изменением объема и окраски. Это сближает жидкие растворы с химическими соединениями. Однако в отличие от обычных чистых веществ растворы могут иметь переменный состав. Их следует поэтому рассматривать как переходное состояние от механических смесей к химическим соединениям.
Состояние ионов в водных растворах зависит от строения их электронных оболочек, природы растворителя, присутствия посторонних веществ и температуры.
Например, разбавленный водный раствор хлорида кобальта (II) имеет розовую окраску за счет образования гидратированных катионов Со(Н2О)29+ . С увеличением температуры гидратные оболочки ионов Со2+ частично разрушаются, причем на место молекул воды встают имеющиеся в растворе анионы:
Со(Н2О)26+ +2Сl— ⇄ [Со(Н2O)4Сl2] +2Н2O
При добавлении концентрированной соляной кислоты происходит полное замещение молекул Н2O на хлоридионы и окраска раствора изменяется от розовой к синей:
Со(Н2O)26+ +4Сl— ⇄ СoCl24— +6Н2О
Аналогичное превращение можно наблюдать при добавлении роданид-ионов:
Co(H2O)26++4SCN— ⇄ Co(SCN)24—+6H2O
Катионы меди существуют в водных растворах в виде окрашенных в синий цвет гексаквокомплексов Cu(H2O)62+. С увеличением концентрации хлоридов молекулы Н2O гидратных оболочек последовательно замещаются ионами Сl— с образованием отрицательно заряженных частиц СuСl42-.
При разбавлении раствора водой равновесие смещается в обратную сторону. В твердом виде безводный хлорид меди окрашен в изумрудно-зеленый цвет.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.