Первые модели атома согласно физику Уильям Томсон который предложил, что атом как облако положительного электричества с вкрапленными в него электронами, которые находятся в некоторых устойчивых положениях, но могут смещаться и совершать колебания под действием внешнего электрического поля. Но другие физики того времени считали, что электроны внутри положительного шара расположены в одной плоскости и образуют концентрические кольца. Поэтому было изначально разработано несколько вариантов строения атомов рис. 2.
Что такое первые модели атома
Начиная с 1888 г. в научном журнале Русского физико химического общества стали появляться статьи с изложением оригинальных взглядов на внутреннюю структуру атомов. Автор этих статей — известный в то время философ Борис Николаевич Чичерин — рассматривал атом как сложную систему, состоящую из положительно заряженной центральной массы и окружающих ее отрицательных оболочек.
Частицы с отрицательным зарядом (электроны) обладали, по его мнению, наибольшей подвижностью, а общее число оболочек возрастало с увеличением атомной массы элемента. К идее планетарного строения атома, в основных чертах совпадающей со взглядами Б. Н. Чичерина, пришел в девяностых годах прошлого века также и другой русский ученый — Николай Александрович Морозов.
В 1901 г. французский физико-химик Жан Батист Перрен опубликовал в журнале Review scientifique статью «Ядерно-планетарная модель атома», где представил атом состоящим из «положительно заряженного ядра , окруженного отрицательными электронами, которые двигаются по определенным «орбитам» со скоростями, соответствующими частотам световых волн». Другим словами, Ж. Перрен теоретически построил будущую экспериментальную модель Э. Резерфорда. Однако его идея оказалась преждевременной, поскольку вопрос о носителе положительного заряда в атоме был ещё неясен.
Изучение строения атомов
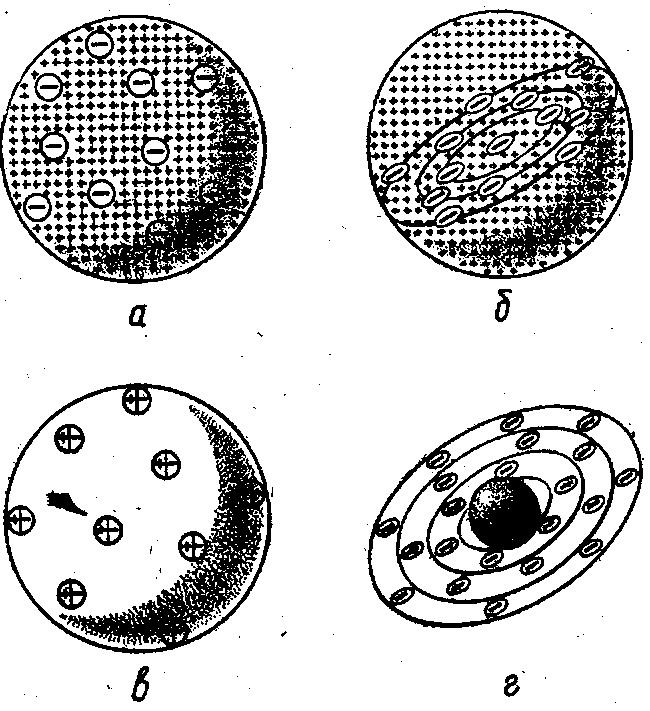
На рубеже XIX и XX вв. широко развернулось изучение рассеяния электронов тонкими металлическими пластинками. Опыты показали, что при прохождении через металлическую фольгу электроны рассеиваются на малые углы. Для объяснения этого явления английский физик Уильям Томсон предложил рассматривать атом как облако положительного электричества с вкрапленными в него электронами, которые находятся в некоторых устойчивых положениях, но могут смещаться и совершать колебания под действием внешнего электрического поля (рис., а). Простейший атом — атом водорода с точки зрения модели У. Томсона представлял собой положительно заряженный шар, в центре которого находится электрон.
Рис. 2. Первые модели атома:
а — У. Томсона (1902), б — Дж. Томсона (1904); е — Ф. Ленарда (1904)( г-Х, Нагаоки (1904).
В отличие от своего соотечественника, Дж. Томсон считал, что электроны внутри положительного шара расположены в одной плоскости и образуют концентрические кольца (рис., б). Возникновение химической связи он объяснял переходом электронов от одного атома к другому. Дж. Томсон впервые попытался связать периодичность в изменении свойств элементов со строением их атомов.
Для этого он предположил, что общее число электронов в атоме непрерывно возрастает при переходе от элемента к элементу. Чтобы определить абсолютное число электронов в атомах различных элементов, ученый предложил изучить рассеяние рентгеновских лучей, полагая при этом, что каждый электрон явится центром их рассеяния. Такие эксперименты были проведены, и оказалось, что количество электронов в атомах легких элементов равно приблизительно половине численного значения их атомной массы.
Немецкий физик Филипп Ленард (1862—1947) отрицал возможность раздельного существования в атоме противоположных электрических зарядов. Согласно его модели атом состоит из нейтральных частиц, каждая из которых является электрическим дуплетом (рис., в). Выполненные Ф. Ленардом расчеты показали, что эти частицы обладают очень малыми размерами и, следовательно, большая часть атома пуста. Связи между строением атома и периодической системой элементов ученый устанавливать не пытался.
Для объяснения характера оптических спектров и явления радиоактивности профессор физики Токийского университета Хантаро Нагаока предложил в 1904 г. свой вариант атомной модели, в котором атом уподоблялся планете Сатурн. Роль самой планеты играл положительно заряженный шар —основная часть атома, вокруг которого, как расположенные в виде колец спутники Сатурна, вращались электроны (рис., г).
Чтобы окончательно решить вопрос о распределения положительного заряда в атоме, Э. Резерфорд предложил изучить рассеяние α-частиц.
Статья на тему Первые модели атома


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.