Жидкости представляют собой одно из основных агрегатных состояний материи, обладающее уникальными физическими и химическими свойствами.
Они характеризуются текучестью, способностью принимать форму сосуда, в котором находятся, и определенной объемной стабильностью.
В отличие от газов, жидкости имеют фиксированный объем, но не фиксированную форму.
Классификация жидкостей может осуществляться по различным критериям:
- По плотности.
- Вязкости.
- Температурным характеристикам
- Химическому составу.
В зависимости от температуры и давления, жидкости могут переходить в газообразное или твердое состояние, что играет важную роль в разнообразных научных и промышленных процессах.
Что такое жидкости
Жидкость или жидкости — это вещества, которые находящееся в нормальных условиях в жидком состоянии (агрегатном), которое при неизменных условиях остается в промежуточном состоянии между газообразного и твердого состояния.
Пример жидкости это вода Н2О.
Причем тщательно очищенная от пыли вода может оставаться в жидком состоянии и при более низкой температуре до — 20 °С.
Жидкое состояние является наименее изученным агрегатным состоянием вещества.
По своему строению жидкости занимают промежуточное положение между твердыми кристаллическими телами со строго определенной периодической структурой и газами.
Характеризующимися отсутствием какой-либо упорядоченности в движении частиц.
Структура и физические свойства жидкостей зависят от химического строения молекул и от характера взаимодействия между ними.
Для жидкостей, образованных полярными молекулами (вода, спирт), характерно явление ассоциации, т. е. сцепление молекул в сложные агрегаты. Определяющую роль в этих процессах играют водородные связи.
Взаимное расположение агрегатов не фиксировано; они способны перемещаться друг относительно друга.
При этом их состав непрерывно меняется.
В общей массе связанных между собой молекул всегда встречаются сгущения, разрежения и даже пустоты, непрерывно мигрирующие по всему объему жидкости.
Время, проходящее между перескоком (трансляцией) частицы из одного агрегата в другой, очень мало.
Оно составляет примерно 10-11 сек. Однако за это время молекула успевает сделать в составе агрегата от десяти до ста колебаний около положения равновесия.
Если на жидкость подействовать импульсом mυ, частота которого соизмерима с частотой трансляций, она начинает проявлять свойства твердого тела — струя жидкости, например раскалывается.
Аналогично этому длительное воздействие большой нагрузки на твердые тела вызывает их течение.
Строение
Вода является одним из самых распространенных в природе веществ. Она покрывает около 3/4 всей земной поверхности, составляя основу океанов, морей, озер, рек, грунтовых вод и болот.
Большое количество воды находится также в атмосфере. Растения и живые организмы содержат в своем составе 50—96% воды.
При температуре от 0 до 100°С и нормальном атмосферном давлении вода находится в жидком состоянии которое характеризуется беспорядочным движением молекул и слабыми связями между ними.
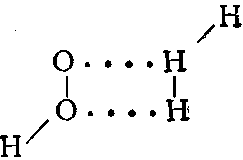
Полярные молекулы воды образуют непрочные ассоциаты переменного состава (Н2О)х.
Наиболее устойчивыми являются удвоенные молекулы (Н2О)2, удерживаемые друг около друга двумя водородными связями:
С увеличением температуры степень ассоциации воды понижается.
Процесс ионизации воды
При взаимодействии ассоциированных молекул происходит обратимый процесс ионизации, приводящий к появлению гидратированных ионов ОН— и Н3О+:
(Н2O)m+ (Н2O)n ⇄ [(Н2O)mН+] + [(Н2O)n-1(OH)—]
или упрощенно
H2O + Н2O ⇄ Н3О+ +ОН—
Экспериментально установлено, что при 22°С из каждых 10 миллионов молекул воды диссоциирует только одна.
Это соответствует концентрации 10-7 г-ион/л Н3О+.
Процесс ионизации происходит с очень большой скоростью. Поэтому между молекулами воды осуществляется непрерывный обмен атомами водорода.
Продолжительность пребывания какого-либо фиксированного атома Н и составе данной молекулы не превышает обычно 10-8 сек.
Свойства воды
Вода способна к значительному переохлаждению, т. е. может оставаться в жидком состоянии при температурах много ниже точки плавления.
Тщательно очищенную от пыли воду можно переохлаждать до —15 и даже до -20°С (переохлажденная жидкость).
При температурах ниже —15°С теплоемкость воды начинает резко увеличиваться, что отражается на структуре жидкости.
Временное изменение свойств воды происходит также в процессе ее тепловой обработки под давлением (нагревание в автоклавах в течение нескольких часов при 300— 100°С).
Такая вода имеет повышенную растворяющую способность по отношению к некоторым солям и более высокую электропроводность.
В последнее время появилось множество сообщений о значительном изменении свойств воды после ее протекания в магнитных полях сравнительно невысокой напряженности.
Эти изменения носят временный характер и через 10—25 ч полностью исчезают.
«Магнитная» вода хуже смачивает твердые поверхности и обладает способностью ускорять процессы кристаллизации растворенных в ней веществ.
Теоретическое объяснение этим явлениям пока не найдено, тем не менее магнитная обработка воды уже нашла широкое применение для очистки воды от взвешенных частиц, предотвращения образования плотных слоев накипи в паровых котлах и улучшения процессов флотации.
Аномальные свойства жидкого гелия
Химический элемент гелий имеет два стабильных изотопа: 32Не и 24Не с атомными массами соответственно 3,016 и 4,003 у. е.
По распространенности во Вселенной гелий занимает второе место после водорода; на его долю приходится около 23% всей массы космического вещества.
Содержание гелия в атмосферном воздухе составляет всего 5 • 10-4 %, поэтому он считается редким элементом.
При обычных условиях гелий представляет собой бесцветный одноатомный газ, умеренно растворимый в воде и других жидкостях.
Вследствие полной симметричности электронных оболочек атомы гелия очень слабо взаимодействуют друг с другом; при атмосферном давлении температура сжижения:
- Гелия-4 равна 4,2К.
- Гелия-3 — 3,2К.
Интенсивность теплового движения атомов при таких низких температурах очень мала, а соответствующая этому движению длина волны де Бройля сравнима с расстоянием между отдельными атомами.
Поэтому состояние жидкого гелия необходимо описывать с помощью законов квантовой механики.
В 1938 г. советский физик Петр Леонидович Капица, изучая скорости протекания жидкого 42Не сквозь узкие щели, обнаружил, что при 2.18 К его вязкость скачкообразно обращается в нуль, т. е. происходит переход гелия-4 в сверхтекучее состояние.
Сверхтекучий 42He обладает необычными свойствами: он самопроизвольно поднимается по капиллярам любой толщины и легко вытекает из не перевернутого сосуда.
Теплопроводность сверхтекучего 42Не в десятки раз выше теплопроводности меди.
Гелий также может переходить в сверхтекучее состояние, приобретая при этом совершенно необычные магнитные свойства.
Важной особенностью жидкого гелия 42Не является также то, что при температуре ниже 0,3К переход Неж → 32Нет, сопровождается не выделением, а поглощением теплоты.
Этот эффект используется для получения сверхнизких температур — вплоть до 0,001К.
Статья на тему Жидкости