Что такое углеводы биологические функции углеводов
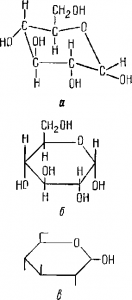
Рис. 12. Различные способы изображения молекулы α-глюкозы.
а — форма кресла; б — схема Хеуорса; в — сокращенная запись формулы.
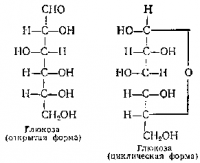
Молекулы моносахаридов в растворе, по-видимому, находятся в двух формах: открытой и циклической. Циклическая форма молекулы изогнута и в общем похожа на кресло. Встречаются (редко) и молекулы углеводов, имеющие форму ванны. Точное исследование формы молекул не всегда возможно, поэтому обычно записывают циклическую форму гак, как на рисунке 12: часть групп ОН находится в верхней части плоскости кольца, часть — ниже ее. Иногда формулу глюкозы записывают сокращенно. В такой записи Г-образный значок заменяет группу CН2OН, а короткие черточки указывают па расположение группы ОН: если черточка направлена внутрь кольца, то гидроксил находится выше плоскости кольца, если во внешнюю сторону — ниже плоскости.
Часто пользуются менее точными, но более удобными для записи проекционными формулами Фишера — Толленса, с помощью которых строение углеводов с открытой или замкнутой цепью изображают так:
Группы СНОН в углеводах содержат асимметрический атом углерода. По этой причине углеводы образуют много стореоизомерных и оптически активных форм. Если число асимметрических атомов в молекуле равно а, то число оптически активных стереоизомерных форм равно 2n. Классификация стереоизомеров построена на следующей основе: за исходное вещество берут глицериновый альдегид, из которого можно посредством циан-гидринного синтеза получить различные углеводы. Характерной особенностью этого синтеза является то, что цепь атомов углерода постепенно наращивается, каждый раз на один атом, причем наращивание начинается с того конца, на котором находится группа СНО.
Если отразить в зеркале написанную пространственную формулу глицеринового альдегида, то получится формула его оптического антипода, т. е. левовращающего изомера:
При отражении в зеркале формул, полученных из правовращающего глицеринового альдегида D-тетроз, получим формулы их оптических изомеров. Напомним, что структуры оптических изомеров никаким движением в пространстве совместить нельзя. Условились относить к D-ряду все те моносахариды, у которых расположение атомов и групп вокруг атомов углерода, наиболее удаленного от карбонильного, такое же, как и у D-глицеринового альдегида. Наращивая цепочку атомов углерода, каждый раз прибавляем группу СНОН к тому концу, где находится карбонил (т. е. мы превращаем СПO в СНОП, а добавленный атом углерода появляется в виде СНО), и следим за тем, чтобы конфигурация вокруг асимметрического атома С, принадлежавшего в исходном веществе глицериновому альдегиду, оставалась неизменной. Отразив все написанные по этому принципу формулы в зеркале, мы, очевидно, получим весь набор углеводов, принадлежащих к D-ряду.
Моносахариды могут содержать альдегидную или кетонную группу и в зависимости от этого называются альдозами или кетозами. Химические реакции, свойственные моносахаридам, характерны, с одной стороны, для этих групп, а с другой—для групп гидроксила, содержащихся во всех углеводах. Таким образом, углеводы вообще являются соединениями со смешанной функцией.
Из моносахаридов альдоз (всего их известно 16 изомеров: 8D-форм и 8L-форм) особенно значительную роль играет глюкоза, иначе называемая декстрозой или виноградным сахаром. В соке плодов и ягод, а также в крови содержится это вещество, активно используемое организмом для получения энергии в разнообразных формах: тепловой, механической (работа мышц) и энергии нервных импульсов.
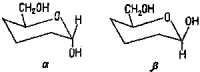
Кроме тех двух форм, о которых уже шла речь, т. е. открытой и замкнутой, молекула глюкозы может существовать еще в двух формах, отличающихся друг от друга расположением одного гидроксила относительно плоскости кольца (рис. 13).
В биологических системах обе эти формы действуют неодинаково, и поэтому различие между α— и β-формами существенно.
В растворах глюкоза существует главным образом в виде циклических молекул. Процент открытой формы очень мал, около 0,02%. 64% глюкозы в растворе представлены β-формой и 36% приходится на α-форму. Кристаллическая глюкоза в основном состоит из α-формы. Если альдегидную форму сравнительно легко окисляющуюся, подвергнуть действию окислителей, то вследствие сдвига химического равновесия между открытой и циклической формами постепенно окислится вся глюкоза. Глюкоза в щелочных растворах при слабом нагревании быстро восстанавливает ионы меди Сu2+ в комплексном соединении меди с винной кислотой (сегнетова соль в щелочной среде и соли меди — реактив Фелинга).
Представителем кетоз является фруктоза (иначе левулёза), содержащаяся во фруктах и более сладкая на вкус, чем глюкоза и даже чем обычный сахар — сахароза. Фруктоза также обладает свойствами восстановителя.
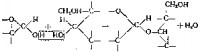
Из двух молекул глюкозы образуется молекула дисахарида именно мальтозы или солодового сахара, содержащегося в прорастающих зернах. Соединение молекул моносахаридов осуществляется за счет взаимодействия двух гидроксилов: в одной молекуле гидроксил принадлежит группе СНОП, соседней с атомом кислорода, замыкающим цикл, а в другой группе СНОН, соседней с группой —С—СН2ОН. В результате от двух групп ОН отщепляется молекула воды и моносахаридные частицы оказываются связанными группами СН2ОН кислородным мостиком:
Из глюкозы и галактозы аналогичным образом получается молочный сахар — лактоза. Соединение молекул глюкозы и фруктозы дает дисахарид сахарозу С12Н22О11. Однако в этом случае в обеих молекулах для связи используются гидроксилы, соседние с замыкающим атомом кислорода:
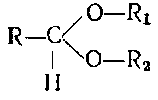
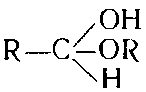
Группа, в которой имеется две эфирные связи у одного атома углерода, характерна для веществ, называемых ацеталями, эта связь устойчива к окислению:
Соединения типа
называют полуацеталями, они легко окисляются. В молекуле мальтозы у одного из остатка глюкозы остается полуацетальиая связь, а в молекуле сахарозы полуацеталыюй связи пет (связь ацетальная). Поэтому сахароза не восстанавливает медь реактива Фелинга и вообще устойчива к окислению. Йод действием кислот или под влиянием ферментов дисахарнды подвергаются гидролизу и снова образуют молекулы моносахаридов.
Статья на тему Биологические функции углеводов


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.