Sm самарий (Samarium; по имени рус. горного инженера В. Е. Самарского-Быховца) — химический элемент 3-й группы, с порядковым номером 62 в периодической системе.
Находится в шестом периоде. Температура плавления: 1072 °С, температура кипения 1790,85 °С. Плотность: 7.54 г/см3.
Электронная формула
Полная электронная конфигурация атома самария в порядке возрастания энергий орбиталей:
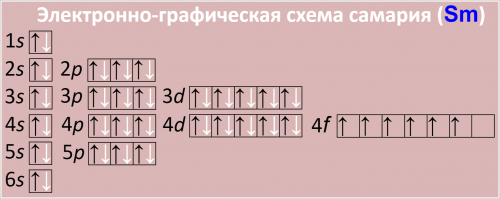
1s22s22p63s23p64s23d104p65s25p66s24f6
Электронная формула атома самария в порядке следования уровней:
1-й уровень: 1s2 (2 электрона)
2-й уровень: 2s22p6 (8 электронов)
3-й уровень: 3s23p63d10 (18 электронов)
4-й уровень: 4s24p64d104f6 (24 электрона)
5-й уровень: 5s25p6 (8 электронов)
6-й уровень: 6s2 (2 электрона)
Сокращенная электронная конфигурация Sm:
[Xe] 4f6 6s2
Электронно-графическая схема самария (Sm)
Рис. Схема распределения электронов по атомным орбиталям в атоме самария.
Энергетические уровни
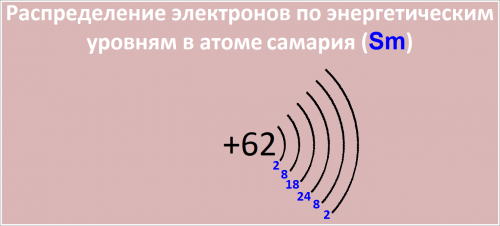
Распределение электронов по энергетическим уровням в атоме Sm:
- -й уровень (K): 2
- -й уровень (L): 8
- -й уровень (M): 18
- -й уровень (N): 24
- -й уровень (O): 8
- -й уровень (P): 2
Рис. Распределение электронов по энергетическим уровням в атоме самария.
В соединениях самарий проявляет степень окисления: +2, +3.
Находится в одной группе с другими элементами, но валентность самария является ключевым свойством, отличающим его от многих других металлов.
Стабильные изотопы
|
Изотоп
|
Протоны
|
Нейтроны
|
Атомная масса изотопа
|
|
144Sm
|
62
|
82
|
~143.911999 |
|
147Sm
|
62
|
85
|
~146.9148979 |
|
148Sm
|
62
|
86
|
~147.9148227 |
|
149Sm
|
62
|
87
|
~148.9171847 |
|
150Sm
|
62
|
88
|
~149.9172755 |
|
152Sm
|
62
|
90
|
~151.9197324 |
|
154Sm
|
62
|
92
|
~153.9222093 |
Природный самарий состоит из изотопов: 144Sm (3,09%), 147Sm (15,07%), 148Sm (11,27%), 149Sm (13,82%), 150Sm (7,47%), 152Sm (26,63%) и 154Sm (22,53%).
Причем изотоп 147Sm — альфа-радиоактивен, с периодом полураспада, равным 1,3 х 1011 лет.
Получены радиоактивные изотопы с массовыми числами 141Sm — 143Sm, 145Sm, 146Sm, 151Sm, 153Sm и 155Sm —157Sm.
Некоторые изотопы самария, образующиеся при делении урана и плутония, являются «реакторными ядами».
Для более глубокого изучения его атомного строения, физических свойств и применения, мы рекомендуем ознакомиться с нашей главной статьей: самарий химический элемент.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.