Os осмий (Osmium; от греч.— запах) — химический элемент, с порядковым номером 76 в периодической системе.
Атомный номер 76, атомная масса 190,2. Находится в шестом периоде. Температура плавления: 3045 ℃, температура кипения 5012 °C. Плотность: 22.61 г/см3.
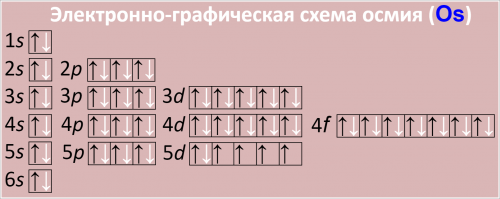
Электронная формула
Полная электронная формула атома осмия в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d6 6s2
Сокращенная электронная конфигурация Os:
[Xe] 4f14 5d6 6s2
Электронная формула атома осмия в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d6
Электронно-графическая схема осмия (Os)
Рис. Схема распределения электронов по атомным орбиталям в атоме осмия.
Энергетические уровни
Распределение электронов по орбиталям в атоме осмия:
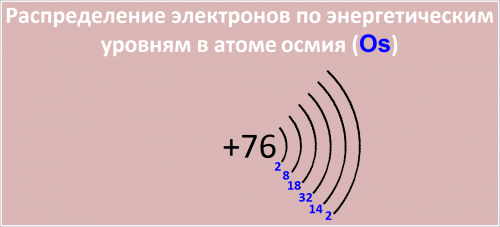
76 Os )2)8)18)32)14)2;
Распределение электронов по энергетическим уровням в атоме Os:
- -й уровень (K): 2
- -й уровень (L): 8
- -й уровень (M): 18
- -й уровень (N): 32
- -й уровень (O): 14
- -й уровень (P): 2
Рис. Распределение электронов по энергетическим уровням в атоме осмия.
Валентные электроны осмия
Количество валентных электронов в атоме — 8.
Таблица квантовых чисел Os (N — главное, L — орбитальное, M — магнитное, S — спин).
| Орбиталь | N | L | M | S |
| s | 6 | 0 | 0 | +1/2 |
| s | 6 | 0 | 0 | -1/2 |
| d | 5 | 2 | -2 | +1/2 |
| d | 5 | 2 | -1 | +1/2 |
| d | 5 | 2 | 0 | +1/2 |
| d | 5 | 2 | 1 | +1/2 |
| d | 5 | 2 | 2 | +1/2 |
| d | 5 | 2 | -2 | -1/2 |
В соединениях осмий проявляет степень окисления: -2, -1, +1, +2, +3, +4, +5, +6, +7, +8.
Находится в одной группе с другими элементами, но валентность осмия является ключевым свойством, отличающим его от многих других элементов.
Стабильные изотопы
| Изотоп | Протоны | Нейтроны | Атомная масса изотопа |
| 184Os | 76 | 108 | ~183.9524891 |
| 186Os | 76 | 110 | ~185.9538382 |
| 187Os | 76 | 111 | ~186.9557505 |
| 188Os | 76 | 112 | ~187.9558382 |
| 189Os | 76 | 113 | ~188.9581475 |
| 190Os | 76 | 114 | ~188.9581475 |
| 192Os | 76 | 116 | ~191.9614807 |
Природный осмий состоит из стабильных изотопов с массовыми числами: 184Os (0,018%), 186Os (1,582%), 187Os (1,64%), 188Os (13,27%), 189Os (16,14%), 190Os (26,38%) и 192Os (40,97%).
Получены радиоактивные изотопы с массовыми числами 180Os — 183Os, 185Os, 191Os, 193Os — 195Os.
Для более глубокого изучения его атомного строения, физических свойств и применения, мы рекомендуем ознакомиться с нашей главной статьей: осмий химический элемент.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.