Ca кальций [Calcium; от лат. calx (calcis) — известь] — химический элемент 2-й группы, с порядковым номером 20 в периодической системе.
Атомный номер 20, атомная масса 40,08. Находится в четверном периоде. Температура плавления: 839 ℃, температура кипения 1482° С. Плотность: 1.54 г/см3.
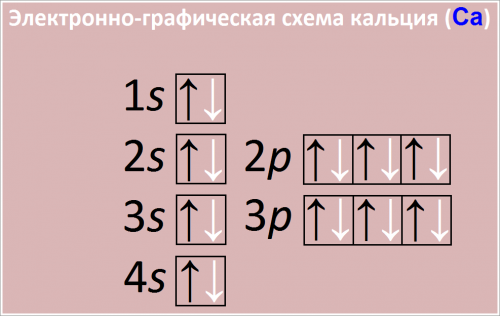
Электронная формула
Электронная формула атома кальция:
1s2 2s2 2p6 3s2 3p6 4s2
Сокращенная электронная конфигурация Ca:
[Ar] 4s2
Электронно-графическая схема кальция (Са)
Рис. Схема распределения электронов по атомным орбиталям в атоме кальция.
Ядерный состав атома кальция — 40, наиболее распространенный изотоп этого элемента состоит из 20 протонов и 20 нейтронов.
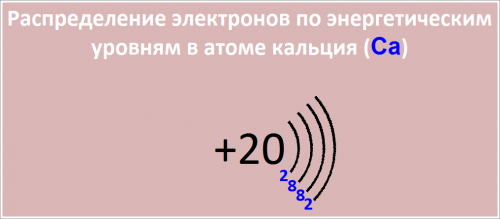
20 электронов занимают доступные электронные оболочки (кольца).
Энергетические уровни
Распределение электронов по энергетическим уровням в атоме Са:
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 8
4-й уровень (N): 2
Рис. Распределение электронов по энергетическим уровням в атоме кальция Са.
Валентные электроны кальция
Количество валентных электронов в атоме кальция — 1.
Таблица квантовых чисел кальция (N — главное, L — орбитальное, M — магнитное, S — спин).
| Орбиталь | N | L | M | S |
| s | 4 | 0 | 0 | +1/2 |
| s | 4 | 0 | 0 | -1/2 |
Степень окисления кальция равна: +2.
Стабильные изотопы
| Изотоп | Протоны | Нейтроны | Атомная масса изотопа |
| 40Ca | 20 | 20 | ~39.96259098 |
| 42Ca | 20 | 22 | ~41.95861801 |
| 43Ca | 20 | 23 | ~42.9587666 |
| 44Ca | 20 | 24 | ~43.9554818 |
| 46Ca | 20 | 26 | ~45.9536926 |
| 48Ca | 20 | 28 | ~47.952534 |
Природный кальция состоит из стабильных изотопов среди к-рых преобладает изотоп 40Са (96,97%).
Из радиоактивных наибольшее значение имеет изотоп 45Са с периодом полураспада 163,5 дня.
Изотоп 48Ca нестабилен, но с большим периодом полураспада.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.