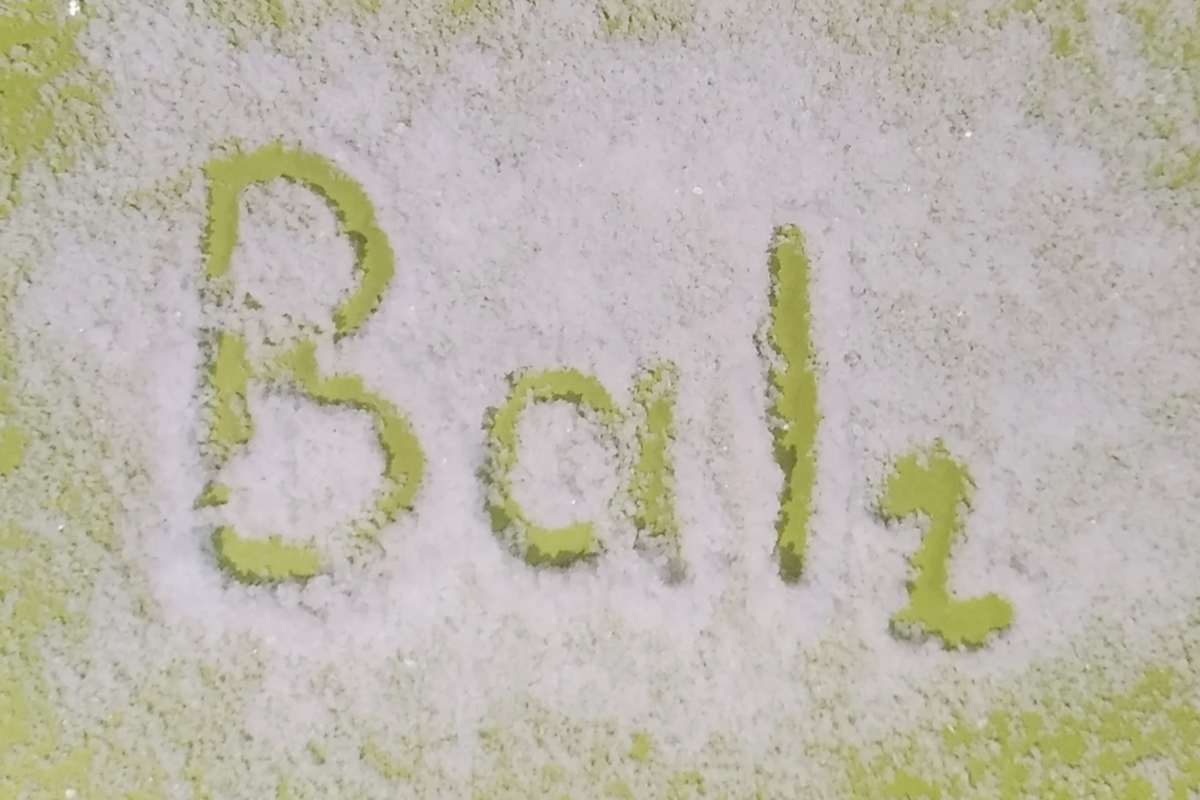Иодид бария это сложное неорганическое соединение в состав которого входит: барий Ва и иод (йод).
Его химическая формула записывается BaI2, применяется для получения иодидов, примером может служить иодид калия.
Что такое иодид бария
Барий относится к элементам 2-й группы, а йод — к элементам 17-й группы. Это означает, что барий (Ba) является щёлочноземельным химически активный металлом, а йод — галогеном.
Металлы и галогены вступают в реакцию с образованием металлогалогенидных соединений, называемых солями, такими как йодид бария. Химическая формула его — BaI2.
Изучение различных соединений галогенидов металлов помогает нам понять природу этих двух типов элементов. Это не единственный факт, который делает его интересным.
Соединения йодида важны в области медицины, а также для производства многих органических соединений.
Он существует в двух формах — дигидратной и безводной.
Дигидратная форма йодида бария это когда наблюдается, что каждая молекула присоединена к двум другим молекулам воды.
Химическая формула дигидрата йодида бария записывается как BaI2 • 2H2O. Безводный йодид бария не будет иметь к себе ни одной молекулы воды.
Мы можем легко получить безводный йодид бария из дигидрата йодида бария, нагревая последний и позволяя молекулам воды испариться. Они представляют собой твердые кристаллы.
Безводный йодид бария имеет вид белого порошка без запаха. Безводный йодид бария существует в 2 различных структурах: структуре 2PbCl и структуре Fe2P -типа Fe.
PbCl2 представляет собой орторомбическую структуру с тригонально-призматической координацией и пилообразной решеткой.
В случае с йодидом бария барий будет находиться посередине, а йод — с обеих сторон соответственно.
Fe2P представляет собой гексагональную структуру с треугольной решеткой и атомом фосфора в центре. В случае иодида бария барий будет находиться посередине.
Физические свойства
Температура плавления 27,5 °C, разлагается при температуре выше 35 °C.
Кристаллогидрат ВаI2·7H2O образует бесцветные кристаллы с плотностью 3,67 г/см3.
Молярная масса 391,136 (безводный), 427,167 (дигидрат) г/моль. Плотность 4,92 (безводный); 5,15 (водный).
Хорошо растворяется в воде, спирте, ацетоне.
Безводный йодид бария представляет собой бесцветный кристаллический порошок ромбической сингонии, параметры ячейки a = 0,8862 нм, b = 1,0566 нм, c = 0,5268 нм, структура типа дихлорида свинца PbCl2.
Кристаллогидрат ВаI2·2H2O представляет собой гигроскопические бесцветные моноклинные кристаллы с плотностью 5,15 г/см3.
Безводный йодид бария представляет собой бесцветный кристаллический порошок ромбической сингонии, параметры ячейки a = 0,8862 нм, b = 1,0566 нм, c = 0,5268 нм, структура типа дихлорида свинца PbCl2.
Химические свойства
Химические свойства йодида бария могут незначительно различаться между безводным йодидом бария и дигидратным йодидом бария.
Это связано с присутствием молекул воды, присоединенных к молекулам йодида бария. Это делает молекулу растворимой в воде, этаноле и ацетоне.
В случае безводного йодида бария, хотя соль стабильна, она чувствительна к воздуху, свету и влаге.
Он также гигроскопичен; это означает, что он легко впитывает воду и кристаллизуется в дигидратную форму йодида бария.
Оба чувствительны к оксидам и токсичны при употреблении. Поскольку они являются галогенидными соединениями металлов, они также являются ионными по своей природе.
Получение
Йодид бария получают в результате реакции молекул бария и йода, поскольку металлы и галогены обладают высокой реакционной способностью.
Поскольку содержание йода в 17-й группе ниже, нам необходимо обеспечить нагрев для протекания реакции.
Ba + I2 → BaI2
В результате реакции йодида калия с нитратом бария в присутствии воды образуется дигидрат:
КI + Ba(NO3)2 → КNО3 + BaI2
Этот тип реакции называется реакцией двойного вытеснения и является обратимым.
Поскольку эта реакция протекает в присутствии воды, за образованием йодида бария следуют молекулы воды, образующие лиганды и продуктом, который мы получим, является дигидрат гидроксида бария.
Нитрат калия растворим в воде, при нагревании мы получаем кристаллизованный безводный йодид бария.
Часто задаваемые вопросы и ответы?
В получении веществ в состав которых входит барий и иод, а также в электронной, космической промышленности и т.д.
Нагреванием бария с иодом, реакцией нитрата бария с другими иодидами.
Как и все соли бария, эта соль считается токсичной.