Что такое гидрометаллургия меди
Перевод меди из сырья в раствор имеет две трудно различимых стадии — химическое взаимодействие минералов с реагентами и растворение возникающих при этом солей в воде.
Выбор реагентов для гидрометаллургии меди
В первом приближении для определения возможности необходимых реакций, выбора реагентов и их концентраций часто полезны термодинамические расчеты равновесия.
Применение для этого уравнений (3) и (4) на основе величия ΔZ°298, часто полученных опытами при высоких температурах и экстраполированных к обычным.
Дает менее надежные результаты, чем использование произведений растворимости, констант ионизации и окислительно-восстановительных потенциалов, измеренных в водных растворах.
Те и другие исходные величины часто не известны для минералов и их приходится заменять данными для сходных химических соединений, что, конечно, позволяет получать только полуколичественные результаты.
Взаимодействие малахита с серной кислотой соответствует уравнению:
Cu2CО3(OH)2 + 2H2SО4 = 2CuSО4 + 2Н2О + СО2.
Считая, что сульфат меди и серная кислота диссоциируют полностью, а в растворе первично образуется угольная кислота, накапливающаяся до предела ее растворимости.
Получим в ионном выражении:
Cu2CО3(OH)2 + 4Н+ = 2Cu2+ + 2Н2О + Н2СО3,
Величина К подтверждает возможность реакции: массы получаемых веществ значительно превышают исходные.
Равновесную кислотность при выщелачивании малахита находят из следующего расчета :
Приняв растворимость Н2СО3 в воде при 20° С равной 3,8• 10-2 моль/л и активность аСu2+ =0,1 г-ион/л (6,4 г/л), найдем:
рН = -lg ан+ = — (1 : 4) (2 lgаСu2+ + lg3,8•10 -2 — 10,89) = 3,77.
Расчет показывает возможность выщелачивания малахита при весьма малой концентрации серной кислоты, то же известно из опыта.
Для ковеллина получим иной результат, приняв рПР = 35,2 и растворимость сероводорода в воде равной 0,11 моль/л:
CuS + 2Н+ = Cu2+ + H2S;
рК = РПРCuS — pKHS- — pKH2S = 15,32; K = 4,8 • 10-16
Растворение халькозина еще менее вероятно, если считать
р/7Р = 47,6; К =2•10-28.
Пирит с разбавленной серной кислотой не реагирует, для реакции:
FeS2 + 2Н+ = Fe2+ + H2S + S; К = 4,8• 1011,
однако раствором сульфата железа он окисляется:
FeS2 + 2Fe3+ = 3Fe2+ + 2S,
1. FeS2 = Fe2+ + S22-, pK = рПРFeS2,
2. в) S22- —2e = 2S, E0 = — 0,48В,
о) 2Fe3+ + 2e = 2Fe2+, E0 = 0,77В,
применив , получим:
pK = pПРFeS2 — pKFe3+/S = — 11,4; K = 3,2 • 1011
Раствор сульфата железа растворяет ковеллин и халькозин, окисляя в CuS серу, а в Cu2S медь и серу:
По минералогическим данным, халькопирит можно представить как CuS • FeS либо Cu2S•FeS.
Еще сложнее структура борнита, по мнению некоторых авторов, сходная с твердыми растворами CuFeS2 и Cu2S.
Стандартные термодинамические величины для этих минералов весьма сомнительны; однако и без расчета ясно, что они не будут взаимодействовать с солями окиси железа и кислотами энергичнее составляющих простых сульфидов меди и железа.
Химизм окисления халькопирита и борнита в растворах солей железа (III) предположительно таков:
CuFeS2 + 4Fe3+ = Cu2+ + 5Fe2+ + 2S,
Cu5FeS4 + 12Fe3+ = 5Cu2++ 13Fe2+ + 4S.
Нет данных и о хризоколле, о которой из опыта известна малая скорость растворения в кислотах, очевидно связанная с возникновением поверхностных пленок SiO2 • nН2О.


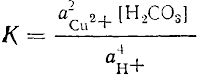

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.